й«ҳдёӯ еҢ–еӯҰ
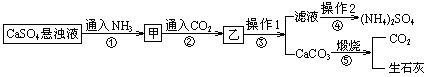
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
 гҖҒ
гҖҒ гҖҒ
гҖҒ гҖҒ
гҖҒ гҖҒ
гҖҒ )еӣһ收еҲ©з”ЁAlе’Ң
)еӣһ收еҲ©з”ЁAlе’Ң зҡ„е·ҘиүәжөҒзЁӢеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
зҡ„е·ҘиүәжөҒзЁӢеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү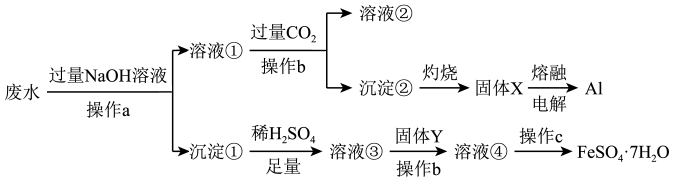
 еҸ‘з”ҹеҸҚеә”
C . жә¶ж¶Ів‘Ўзҡ„жә¶иҙЁдё»иҰҒжҳҜNaClе’Ң
еҸ‘з”ҹеҸҚеә”
C . жә¶ж¶Ів‘Ўзҡ„жә¶иҙЁдё»иҰҒжҳҜNaClе’Ң D . еӣәдҪ“YеҸҜд»ҘжҳҜй“ҒзІү
D . еӣәдҪ“YеҸҜд»ҘжҳҜй“ҒзІү
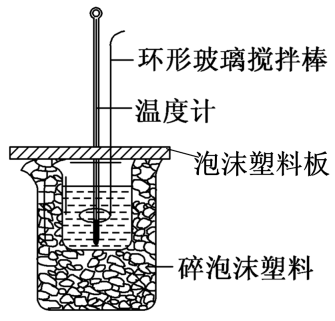
в‘ з”ЁйҮҸзӯ’йҮҸеҸ–50mL0.50molВ·L-1зӣҗй…ёеҖ’е…Ҙе°Ҹзғ§жқҜдёӯпјҢжөӢеҮәзӣҗй…ёжё©еәҰпјӣв‘Ўз”ЁеҸҰдёҖйҮҸзӯ’йҮҸеҸ–50mL0.55molВ·L-1NaOHжә¶ж¶ІпјҢ并用еҗҢдёҖжё©еәҰи®ЎжөӢеҮәе…¶жё©еәҰпјӣв‘ўе°ҶNaOHжә¶ж¶ІеҖ’е…Ҙе°Ҹзғ§жқҜдёӯпјҢдҪҝд№Ӣж··еҗҲеқҮеҢҖпјҢжөӢеҫ—ж··еҗҲжә¶ж¶ІжңҖй«ҳжё©еәҰгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү жүҖз”ЁNaOHжә¶ж¶ІиҰҒзЁҚиҝҮйҮҸпјҢзҗҶз”ұжҳҜгҖӮ
-
пјҲ2пјү еҰӮеӣҫиЈ…зҪ®дёӯзўҺжіЎжІ«еЎ‘ж–ҷеҸҠжіЎжІ«еЎ‘ж–ҷжқҝзҡ„дҪңз”ЁжҳҜгҖӮ
-
пјҲ3пјү зҺҜеҪўзҺ»з’ғжҗ…жӢҢжЈ’жҗ…жӢҢжә¶ж¶Ізҡ„ж“ҚдҪңжҳҜгҖӮ
-
пјҲ4пјү еҒҮи®ҫзӣҗй…ёе’ҢNaOHжә¶ж¶Ізҡ„еҜҶеәҰйғҪжҳҜ1gВ·cm-3 пјҢ еҸҲзҹҘдёӯе’ҢеҸҚеә”еҗҺз”ҹжҲҗжә¶ж¶Ізҡ„жҜ”зғӯе®№c=4.18JВ·g-1В·в„ғ-1гҖӮдёәдәҶи®Ўз®—дёӯе’ҢзғӯпјҢжҹҗеӯҰз”ҹе®һйӘҢи®°еҪ•ж•°жҚ®еҰӮиЎЁжүҖзӨәпјҡ
е®һйӘҢеәҸеҸ·
иө·е§Ӣжё©еәҰT1/в„ғ
з»Ҳжӯўжё©еәҰT2/в„ғ
зӣҗй…ё
NaOHжә¶ж¶І
ж··еҗҲжә¶ж¶І
1
20.0
20.1
23.2
2
20.2
20.4
23.4
3
20.5
20.6
23.6
дҫқжҚ®иҜҘеӯҰз”ҹзҡ„е®һйӘҢж•°жҚ®и®Ўз®—пјҢиҜҘе®һйӘҢжөӢеҫ—зҡ„дёӯе’Ңзғӯ|в–іH|=(е°Ҹж•°зӮ№еҗҺдҝқз•ҷ1дҪҚж•°еӯ—)гҖӮ
-
пјҲ5пјү (йҖүеЎ«вҖңиғҪвҖқжҲ–вҖңдёҚиғҪвҖқ)з”ЁBa(OH)2жә¶ж¶Іе’ҢH2SO4жә¶ж¶Ід»ЈжӣҝNaOHжә¶ж¶Іе’Ңзӣҗй…ёпјҢзҗҶз”ұжҳҜгҖӮ
-
пјҲ6пјү зҺ°е°ҶдёҖе®ҡйҮҸзҡ„зЁҖNaOHжә¶ж¶ІгҖҒCa(OH)2жә¶ж¶ІгҖҒзЁҖж°Ёж°ҙеҲҶеҲ«е’Ң1L1molВ·L-1зҡ„зӣҗй…ёжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢе…¶еҸҚеә”зғӯеҲҶеҲ«дёәв–іH1гҖҒв–іH2гҖҒв–іH3 пјҢ еҲҷв–іH1гҖҒв–іH2гҖҒв–іH3зҡ„еӨ§е°Ҹе…ізі»дёәгҖӮ
 жә¶ж¶Іе’Ң
жә¶ж¶Іе’Ң жә¶ж¶ІдёӯйҖҗж»ҙж»ҙеҠ
жә¶ж¶ІдёӯйҖҗж»ҙж»ҙеҠ  зҡ„зЁҖзӣҗй…ёпјҢз”ЁеҺӢејәдј ж„ҹеҷЁжөӢеҫ—еҺӢејәйҡҸзӣҗй…ёдҪ“з§Ҝзҡ„еҸҳеҢ–жӣІзәҝеҰӮеӣҫ2жүҖзӨәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
зҡ„зЁҖзӣҗй…ёпјҢз”ЁеҺӢејәдј ж„ҹеҷЁжөӢеҫ—еҺӢејәйҡҸзӣҗй…ёдҪ“з§Ҝзҡ„еҸҳеҢ–жӣІзәҝеҰӮеӣҫ2жүҖзӨәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
 жә¶ж¶Ізҡ„ж»ҙе®ҡжӣІзәҝ
B . bзӮ№жә¶ж¶Ізҡ„pHеӨ§дәҺcзӮ№жә¶ж¶Ізҡ„pH
C . cзӮ№зҡ„жә¶ж¶Ідёӯпјҡ
жә¶ж¶Ізҡ„ж»ҙе®ҡжӣІзәҝ
B . bзӮ№жә¶ж¶Ізҡ„pHеӨ§дәҺcзӮ№жә¶ж¶Ізҡ„pH
C . cзӮ№зҡ„жә¶ж¶Ідёӯпјҡ D . aгҖҒdдёӨзӮ№ж°ҙзҡ„з”өзҰ»зЁӢеәҰпјҡa>d
D . aгҖҒdдёӨзӮ№ж°ҙзҡ„з”өзҰ»зЁӢеәҰпјҡa>d
 +3Clп№Ј+5H2OпјҢеҲҷRO
+3Clп№Ј+5H2OпјҢеҲҷRO  дёӯRзҡ„еҢ–еҗҲд»·жҳҜпјҲВ В пјү
дёӯRзҡ„еҢ–еҗҲд»·жҳҜпјҲВ В пјү
AВ В В В В В В В В В В BВ В В В В В В В В В В CВ В В В В В В
DВ В В В В В В В В В В EпјҺ
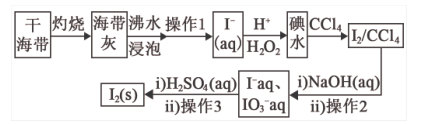
дёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
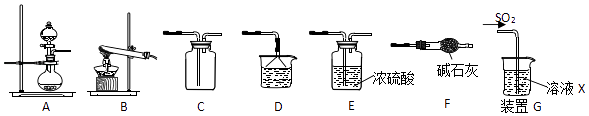
-
пјҲ1пјү ж №жҚ®дёҠиҝ°еҺҹзҗҶеҲ¶еӨҮ并收йӣҶе№ІзҮҘSO2зҡ„е®һйӘҢиЈ…зҪ®иҝһжҺҘйЎәеәҸдёәпјҺ
-
пјҲ2пјү DдёӯзӣӣиЈ…зҡ„иҜ•еүӮдёәпјҺ
-
пјҲ3пјү з”ІеҗҢеӯҰз”ЁжіЁе°„еҷЁеҗёеҸ–зәҜеҮҖзҡ„SO2并结еҗҲиЈ…зҪ®GиҝӣиЎҢSO2зҡ„жҖ§иҙЁе®һйӘҢпјҢиӢҘXжҳҜNa2Sжә¶ж¶ІпјҢе…¶зӣ®зҡ„жҳҜжЈҖйӘҢSO2зҡ„пјҢеҸҜи§ӮеҜҹеҲ°зҡ„зҺ°иұЎпјҺ
-
пјҲ4пјү е®һйӘҢ1пјҡд№ҷеҗҢеӯҰе°Ҷжә¶ж¶ІXжҚўдёәжө“еәҰеқҮдёә0.1mol/L FeпјҲNO3пјү3е’ҢBaCl2зҡ„ж··еҗҲжә¶ж¶ІпјҲе·Із»ҸйҷӨеҺ»жә¶и§Јж°§пјүпјҢйҖҡе…Ҙе°‘йҮҸSO2еҗҺи§ӮеҜҹеҲ°зғ§жқҜдә§з”ҹзҷҪиүІжІүж·ҖпјҢд№ҷеҗҢеӯҰи®ӨдёәзҷҪиүІжІүж·ҖдёәBaSO4 пјҢ дёәжҺўз©¶зҷҪиүІжІүж·Җзҡ„жҲҗеӣ пјҢ他继з»ӯиҝӣиЎҢеҰӮдёӢе®һйӘҢйӘҢиҜҒпјҡпјҲе·ІзҹҘпјҡ0.1mol/L FeпјҲNO3пјү 3зҡ„pH=2пјү
е®һйӘҢ
ж“ҚдҪң
зҺ°иұЎ
з»“и®әе’Ңи§ЈйҮҠ
2
е°ҶSO2йҖҡе…Ҙ0.1mol/Lе’ҢBaCl2ж··еҗҲж¶І
дә§з”ҹзҷҪиүІжІүж·Җ
Fe3+иғҪж°§еҢ–H2SO3
3
е°ҶSO2йҖҡе…ҘВ е’Ң BaCl2ж··еҗҲж¶І
дә§з”ҹзҷҪиүІжІүж·Җ
й…ёжҖ§жқЎд»¶NO3п№ЈиғҪе°ҶH2SO3ж°§еҢ–дёәSO42п№Ј
-
пјҲ5пјү дёҷеҗҢеӯҰи®Өдёәд»ҘдёҠе®һйӘҢеҸӘиғҪиҜҙжҳҺFe3+е’Ңй…ёжҖ§жқЎд»¶дёӢNO3п№ЈеқҮиғҪе°ҶH2SO3ж°§еҢ–дёәSO42п№Ј пјҢ дёҚиғҪиҜҙжҳҺи°Ғе…Ҳж°§еҢ–H2SO3 пјҢ д»–еҲ©з”ЁжҸҗдҫӣзҡ„иҜ•еүӮпјҲйҷҗйҖүиҜ•еүӮпјҡKSCNжә¶ж¶ІпјҢK3[FeпјҲCNпјү6]жә¶ж¶ІпјҢиӢҜй…ҡжә¶ж¶ІпјҢзЎқй…ёжә¶ж¶Іпјүи®ҫи®Ўе®һйӘҢж–№жЎҲжҺўз©¶дҪ•з§Қеҫ®зІ’е…ҲеҸ‘з”ҹеҸҚеә”пјҺиҜ·её®еҠ©д»–е®ҢжҲҗж–№жЎҲпјҲеҢ…жӢ¬ж“ҚдҪңзҺ°иұЎе’Ңз»“и®әпјүпјҡеҸ–д№ҷеҗҢеӯҰе®һйӘҢ1еҗҺиЈ…зҪ®Gдёӯзғ§жқҜзҡ„дёҠеұӮжё…ж¶ІдәҺиҜ•з®ЎдёӯпјҢпјҺ
-
пјҲ6пјү дёҒеҗҢеӯҰеңЁе®һйӘҢ2иҝҮзЁӢеҸ‘зҺ°пјҢй»„иүІжә¶ж¶Іе…ҲеҸҳзәўжЈ•иүІеҗҺж…ўж…ўеҸҳжө…з»ҝиүІпјҢжҹҘйҳ…иө„ж–ҷеҫ—пјҡFe3++6SO2вҮҢFeпјҲSO2пјү63+пјҲзәўжЈ•иүІпјүпјҺиҜ·з”ЁеҢ–еӯҰ平衡移еҠЁеҺҹзҗҶи§ЈйҮҠе®һйӘҢ2дёӯжә¶ж¶ІйўңиүІеҸҳеҢ–зҡ„еҺҹеӣ пјҺ
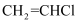 )
B . иЈӮеҢ–еҠ е·Ҙз”ЁдәҺжҸҗй«ҳиҪ»иҙЁжІ№зҡ„дә§йҮҸпјҢжүҖеҫ—еҲ°зҡ„иҪ»иҙЁжІ№иғҪдҪҝй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІиӨӘиүІ
C .
)
B . иЈӮеҢ–еҠ е·Ҙз”ЁдәҺжҸҗй«ҳиҪ»иҙЁжІ№зҡ„дә§йҮҸпјҢжүҖеҫ—еҲ°зҡ„иҪ»иҙЁжІ№иғҪдҪҝй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІиӨӘиүІ
C .  зҡ„дёҖжәҙд»Јзү©жңү4з§Қ
D . з…ӨеҸҜд»ҘзӣҙжҺҘж¶ІеҢ–пјҢеңЁдёҖе®ҡжқЎд»¶дёӢз…ӨдёҺж°ўж°”дҪңз”ЁеҸҜд»Ҙеҫ—еҲ°ж¶ІдҪ“зҮғж–ҷ
зҡ„дёҖжәҙд»Јзү©жңү4з§Қ
D . з…ӨеҸҜд»ҘзӣҙжҺҘж¶ІеҢ–пјҢеңЁдёҖе®ҡжқЎд»¶дёӢз…ӨдёҺж°ўж°”дҪңз”ЁеҸҜд»Ҙеҫ—еҲ°ж¶ІдҪ“зҮғж–ҷ
-
пјҲ1пјү еҹәжҖҒZnеҺҹеӯҗзҡ„д»·з”өеӯҗжҺ’еёғејҸдёәгҖӮ
-
пјҲ2пјү ZnеҺҹеӯҗиғҪеҪўжҲҗеӨҡз§Қй…ҚдҪҚеҢ–еҗҲзү©гҖӮдёҖз§Қй”Ңзҡ„й…ҚеҗҲзү©з»“жһ„еҰӮеӣҫпјҡ

в‘ е…¶дёӯCгҖҒNгҖҒOгҖҒZnе…ғзҙ зҡ„第дёҖз”өзҰ»иғҪеӨ§е°Ҹе…ізі»жҳҜпјҢз»“жһ„дёӯеҸӮдёҺsp3жқӮеҢ–еҺҹеӯҗжңүдёӘгҖӮ
в‘Ўй…ҚдҪҚй”®в‘ е’Ңв‘ЎзӣёжҜ”гҖӮиҫғзЁіе®ҡзҡ„жҳҜпјӣй”®и§’в‘ўй”®и§’в‘Ј(еЎ«вҖң>вҖқгҖҒвҖң<вҖқгҖҒвҖң=вҖқ)гҖӮ
-
пјҲ3пјү (CH3COO)2Znе’ҢZnC2O4дёӯйҳҙзҰ»еӯҗеҜ№еә”зҡ„й…ёдёӯжІёзӮ№иҫғй«ҳзҡ„жҳҜ(еҶҷз»“жһ„з®ҖејҸ)пјҢеҺҹеӣ жҳҜгҖӮ
-
пјҲ4пјү ZnOеӯҳеңЁеӨҡз§Қжҷ¶дҪ“з»“жһ„пјҢе…¶дёӯзәӨй”ҢзҹҝеһӢе’Ңй—Әй”ҢзҹҝеһӢжҳҜжңҖеёёи§Ғзҡ„жҷ¶дҪ“з»“жһ„пјҢдёӢеӣҫдёәиҝҷдёӨз§Қжҷ¶дҪ“зҡ„еұҖйғЁз»“жһ„гҖӮ
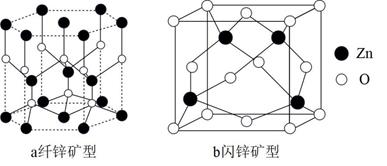
в‘ еӣҫaзәӨй”ҢзҹҝеһӢZnOжҷ¶дҪ“дёӯO2-зҡ„й…ҚдҪҚж•°дёәгҖӮ
в‘Ўй—Әй”ҢзҹҝеһӢдёӯZn2+еЎ«е…ҘO2-жүҖеҪўжҲҗзҡ„вҖңжӯЈеӣӣйқўдҪ“вҖқз©әйҡҷдёӯпјҢй—Әй”Ңзҹҝжҷ¶иғһдёӯеҗ«жңүдёӘвҖңжӯЈеӣӣйқўдҪ“вҖқз©әйҡҷгҖӮ
в‘ўеӣҫbй—Әй”ҢзҹҝеһӢжҷ¶иғһеҜҶеәҰдёәПҒg/cm3.еҲҷZn2+дёҺO2-зҡ„и·қзҰ»дёәnmгҖӮ(и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖј)
жҹҗз ”з©¶жҖ§еӯҰд№ е°Ҹз»„дёәдәҶжҺўз©¶йҶӢй…ёзҡ„з”өзҰ»жғ…еҶөпјҢиҝӣиЎҢдәҶеҰӮдёӢе®һйӘҢпјҺ
е®һйӘҢдёҖВ й…ҚеҲ¶е№¶ж Үе®ҡйҶӢй…ёжә¶ж¶Ізҡ„жө“еәҰеҸ–еҶ°йҶӢй…ёй…ҚеҲ¶250mL 0.2molвҖўLп№Ј1зҡ„йҶӢй…ёжә¶ж¶ІпјҢз”Ё0.2molвҖўLп№Ј1зҡ„йҶӢй…ёжә¶ж¶ІзЁҖйҮҠжҲҗжүҖйңҖжө“еәҰзҡ„жә¶ж¶ІпјҢеҶҚз”ЁNaOHж ҮеҮҶжә¶ж¶ІеҜ№жүҖй…ҚйҶӢй…ёжә¶ж¶Ізҡ„жө“еәҰиҝӣиЎҢж Үе®ҡпјҺ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
пјҲ1пјүй…ҚеҲ¶250mL 0.2molвҖўLп№Ј1йҶӢй…ёжә¶ж¶Іж—¶йңҖиҰҒз”ЁеҲ°зҡ„зҺ»з’ғд»ӘеҷЁжңүйҮҸзӯ’гҖҒзғ§жқҜгҖҒзҺ»з’ғжЈ’гҖҒгҖҖгҖҖе’ҢгҖҖгҖҖпјҺ
пјҲ2пјүдёәж Үе®ҡйҶӢй…ёжә¶ж¶Ізҡ„еҮҶзЎ®жө“еәҰпјҢз”Ё0.2000molпјҺLп№Ј1зҡ„NaOHжә¶ж¶ІеҜ№20.00mLйҶӢй…ёжә¶ж¶ІиҝӣиЎҢж»ҙе®ҡпјҢеҮ ж¬Ўж»ҙе®ҡж¶ҲиҖ—NaOHжә¶ж¶Ізҡ„дҪ“з§ҜеҰӮдёӢпјҡ
| е®һйӘҢеәҸеҸ· | 1 | 2 | 3 | 4 |
| ж¶ҲиҖ—NaOHжә¶ж¶Ізҡ„дҪ“з§ҜпјҲmLпјү | 20.05 | 20.00 | 18.80 | 19.95 |
еҲҷиҜҘйҶӢй…ёжә¶ж¶Ізҡ„еҮҶзЎ®жө“еәҰдёәгҖҖгҖҖпјҺпјҲдҝқз•ҷе°Ҹж•°зӮ№еҗҺеӣӣдҪҚпјү
е®һйӘҢдәҢВ жҺўз©¶жө“еәҰеҜ№йҶӢй…ёз”өзҰ»зЁӢеәҰзҡ„еҪұе“Қ
з”ЁpHи®ЎжөӢе®ҡ25в„ғж—¶дёҚеҗҢжө“еәҰзҡ„йҶӢй…ёзҡ„pHпјҢз»“жһңеҰӮдёӢпјҡ
| йҶӢй…ёжө“еәҰпјҲmolвҖўLп№Ј1пјү | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
пјҲ1пјүж №жҚ®иЎЁдёӯж•°жҚ®пјҢеҸҜд»Ҙеҫ—еҮәйҶӢй…ёжҳҜејұз”өи§ЈиҙЁзҡ„з»“и®әпјҢдҪ и®Өдёәеҫ—еҮәжӯӨз»“и®әзҡ„дҫқжҚ®жҳҜпјҡгҖҖгҖҖпјҺ
пјҲ2пјүд»ҺиЎЁдёӯзҡ„ж•°жҚ®пјҢиҝҳеҸҜд»Ҙеҫ—еҮәеҸҰдёҖз»“и®әпјҡйҡҸзқҖйҶӢй…ёжө“еәҰзҡ„еҮҸе°ҸпјҢйҶӢй…ёзҡ„з”өзҰ»зЁӢеәҰе°ҶгҖҖпјҲеЎ«вҖңеўһеӨ§вҖқеҮҸе°ҸвҖқжҲ–вҖңдёҚеҸҳвҖқпјү
зҰ»еӯҗеҸҚеә”жҳҜдёӯеӯҰеҢ–еӯҰдёӯйҮҚиҰҒзҡ„еҸҚеә”зұ»еһӢгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
(1)еңЁеҸ‘з”ҹзҰ»еӯҗеҸҚеә”зҡ„еҸҚеә”зү©жҲ–з”ҹжҲҗзү©дёӯпјҢдёҖе®ҡеӯҳеңЁжңү________(еЎ«еәҸеҸ·)гҖӮ
в‘ еҚ•иҙЁгҖҖв‘Ўж°§еҢ–зү©гҖҖв‘ўз”өи§ЈиҙЁгҖҖв‘ЈзӣҗгҖҖв‘ӨеҢ–еҗҲзү©
(2)еҸҜз”ЁеӣҫзӨәзҡ„ж–№жі•иЎЁзӨәдёҚеҗҢеҸҚеә”зұ»еһӢд№Ӣй—ҙзҡ„е…ізі»гҖӮеҰӮеҲҶи§ЈеҸҚеә”е’Ңж°§еҢ–иҝҳеҺҹеҸҚеә”еҸҜиЎЁзӨәдёәдёӢеӣҫгҖӮиҜ·еңЁдёӢйқўзҡ„ж–№жЎҶдёӯз”»еҮәзҰ»еӯҗеҸҚеә”гҖҒзҪ®жҚўеҸҚеә”е’Ңж°§еҢ–иҝҳеҺҹеҸҚеә”дёүиҖ…д№Ӣй—ҙзҡ„е…ізі»гҖӮ

(3)зҰ»еӯҗж–№зЁӢејҸжҳҜйҮҚиҰҒзҡ„еҢ–еӯҰз”ЁиҜӯгҖӮдёӢеҲ—жҳҜжңүе…ізҰ»еӯҗж–№зЁӢејҸзҡ„дёҖдәӣй”ҷиҜҜи§ӮзӮ№пјҢиҜ·еңЁдёӢеҲ—иЎЁж јдёӯз”Ёзӣёеә”зҡ„вҖңзҰ»еӯҗж–№зЁӢејҸвҖқеҗҰе®ҡиҝҷдәӣи§ӮзӮ№гҖӮ
| в‘ жүҖжңүзҡ„зҰ»еӯҗж–№зЁӢејҸеқҮеҸҜд»ҘиЎЁзӨәдёҖзұ»еҸҚеә” | |
| в‘Ўй…ёзўұдёӯе’ҢеҸҚеә”еқҮеҸҜиЎЁзӨәдёәHпјӢпјӢOHпјҚ===H2O | |
| в‘ўзҰ»еӯҗж–№зЁӢејҸдёӯеҮЎжҳҜйҡҫжә¶жҖ§й…ёгҖҒзўұгҖҒзӣҗеқҮиҰҒж ҮвҖңвҶ“вҖқз¬ҰеҸ· |
(4)иҜ•еҲ—дёҫеҮәдёүз§ҚдёҚеҗҢзұ»еҲ«зҡ„зү©иҙЁ(й…ёгҖҒзўұгҖҒзӣҗ)д№Ӣй—ҙзҡ„еҸҚеә”пјҢе®ғ们еҜ№еә”зҡ„зҰ»еӯҗж–№зЁӢејҸйғҪеҸҜз”ЁвҖңBa2пјӢпјӢSO![]() ===BaSO4вҶ“вҖқжқҘиЎЁзӨәпјҢиҜ·еҶҷеҮәжңүе…іеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ(3дёӘ)пјҡ
===BaSO4вҶ“вҖқжқҘиЎЁзӨәпјҢиҜ·еҶҷеҮәжңүе…іеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ(3дёӘ)пјҡ
в‘ _______________________________________________________________пјӣ
в‘Ў_______________________________________________________________пјӣ
в‘ў_______________________________________________________________гҖӮ
LiвҖ”CuOдәҢж¬Ўз”өжұ зҡ„жҜ”иғҪйҮҸй«ҳгҖҒе·ҘдҪңжё©еәҰе®ҪпјҢжҖ§иғҪдјҳејӮпјҢе№ҝжіӣеә”з”ЁдәҺеҶӣдәӢе’Ңз©әй—ҙйўҶеҹҹгҖӮ
пјҲ1пјүLiвҖ”CuOз”өжұ дёӯпјҢйҮ‘еұһй”ӮеҒҡ_______жһҒ гҖӮ
пјҲ2пјүжҜ”иғҪйҮҸжҳҜжҢҮж¶ҲиҖ—еҚ•дҪҚиҙЁйҮҸзҡ„з”өжһҒжүҖйҮҠж”ҫзҡ„з”өйҮҸпјҢз”ЁжқҘиЎЎйҮҸз”өжұ зҡ„дјҳеҠЈгҖӮжҜ”иҫғLiгҖҒNaгҖҒAlеҲҶеҲ«дҪңдёәз”өжһҒж—¶жҜ”иғҪйҮҸзҡ„еӨ§е°Ҹпјҡ____________гҖӮ
пјҲ3пјүйҖҡиҝҮеҰӮдёӢиҝҮзЁӢеҲ¶еӨҮCuOгҖӮ
![]()
в‘ В В В В иҝҮзЁӢв… пјҢH2O2зҡ„дҪңз”ЁжҳҜ__________________гҖӮ
В В В В в‘ЎиҝҮзЁӢв…Ўдә§з”ҹCu2(OH)2CO3зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜ_____________________гҖӮ
В В В В в‘ўиҝҮзЁӢв…ЎпјҢе°ҶCuSO4жә¶ж¶ІеҠ еҲ°Na2CO3жә¶ж¶ІдёӯпјҢз ”з©¶дәҢиҖ…дёҚеҗҢзү©иҙЁзҡ„йҮҸд№ӢжҜ”дёҺдә§е“ҒзәҜеәҰзҡ„е…ізі»пјҲз”ЁжөӢе®ҡй“ңе…ғзҙ зҡ„зҷҫеҲҶеҗ«йҮҸжқҘиЎЁеҫҒдә§е“Ғзҡ„зәҜеәҰпјүпјҢз»“жһңеҰӮдёӢпјҡ
е·ІзҹҘпјҡCu2(OH)2CO3дёӯй“ңе…ғзҙ зҡ„зҷҫеҲҶеҗ«йҮҸдёә57.7%гҖӮ

В В В В В дәҢиҖ…жҜ”еҖјдёә1:0.8ж—¶пјҢдә§е“ҒдёӯеҸҜиғҪеҗ«жңүзҡ„жқӮиҙЁжҳҜ_____________пјҢдә§з”ҹиҜҘжқӮиҙЁзҡ„еҺҹеӣ жҳҜ_________________________________гҖӮ
В В В в‘Ј иҝҮзЁӢв…ўеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ_________________________гҖӮ
пјҲ4пјүLiвҖ”CuOдәҢж¬Ўз”өжұ д»Ҙеҗ«Li+зҡ„жңүжңәжә¶ж¶Ідёәз”өи§ЈиҙЁжә¶ж¶ІпјҢе…¶е·ҘдҪңеҺҹзҗҶзӨәж„ҸеҰӮдёӢгҖӮ
 ж”ҫз”өж—¶пјҢжӯЈжһҒзҡ„з”өжһҒеҸҚеә”ејҸжҳҜ______________________гҖӮ
ж”ҫз”өж—¶пјҢжӯЈжһҒзҡ„з”өжһҒеҸҚеә”ејҸжҳҜ______________________гҖӮ
з”ҹжҖҒеҶңдёҡж¶үеҸҠеҶң家еәҹж–ҷзҡ„з»јеҗҲеҲ©з”ЁпјҢжҹҗз§ҚиӮҘж–ҷз»ҸеҸ‘й…өеҫ—еҲ°дёҖз§Қеҗ«з”Ізғ·гҖҒдәҢж°§еҢ–зўігҖҒж°®ж°”зҡ„ж··еҗҲж°”дҪ“гҖӮ2.016 L(ж ҮеҮҶзҠ¶еҶө)иҜҘж°”дҪ“йҖҡиҝҮзӣӣжңүзәўзғӯCuOзІүжң«зҡ„зЎ¬иҙЁзҺ»з’ғз®ЎпјҢеҸ‘з”ҹзҡ„еҸҚеә”дёәCH4пјӢ4CuOCO2пјӢ2H2OпјӢ4CuгҖӮеҪ“з”Ізғ·е®Ңе…ЁеҸҚеә”еҗҺпјҢзЎ¬иҙЁзҺ»з’ғз®Ўзҡ„иҙЁйҮҸеҮҸиҪ»4.8 gгҖӮе°ҶеҸҚеә”еҗҺдә§з”ҹзҡ„ж°”дҪ“йҖҡиҝҮиҝҮйҮҸзҡ„жҫ„жё…зҹізҒ°ж°ҙдёӯпјҢе……еҲҶеҗёж”¶пјҢз”ҹжҲҗжІүж·Җ8.5 gгҖӮжұӮпјҡ
(1)еҺҹж··еҗҲж°”дҪ“дёӯз”Ізғ·зҡ„зү©иҙЁзҡ„йҮҸгҖӮ
(2)еҺҹж··еҗҲж°”дҪ“дёӯж°®ж°”зҡ„дҪ“з§ҜеҲҶж•°гҖӮ
е·ІзҹҘпјҡMg2SiпјӢ4HCl===SiH4вҶ‘пјӢ2MgCl2пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
AпјҺеҺҹеӯҗеҚҠеҫ„пјҡSi>Mg гҖҖВ В В В В В В В В В В В В В В В В В BпјҺж°ўе…ғзҙ дёҚеӯҳеңЁеҗҢдҪҚзҙ
CпјҺиҜҘеҸҚеә”зҶөеўһгҖҖВ В В В В В В В В В В В В В В В В В В В В В В В В DпјҺSiH4жҜ”HClзЁіе®ҡ
дёӢеҲ—еҸҚеә”иҫҫеҲ°е№іиЎЎж—¶дҝқжҢҒжё©еәҰдёҚеҸҳпјҢеҗ‘е®№еҷЁдёӯйҖҡе…Ҙж°©ж°”пјҢеҢ–еӯҰе№іиЎЎдёҖе®ҡдёҚ移еҠЁзҡ„жҳҜ
| A.В PCl5В (g)В C.В 2HI(g)В |
жҹҗз§ҚжҝҖе…үжҹ“ж–ҷпјҢеә”з”ЁдәҺеҸҜи°ғи°җжҹ“ж–ҷжҝҖе…үеҷЁпјҢе®ғз”ұCгҖҒHгҖҒOдёүз§Қе…ғзҙ з»„жҲҗпјҢеҲҶеӯҗзҗғжЈҚеһӢеҰӮеҸіеӣҫжүҖзӨәпјҢдёӢеҲ—жңүе…іеҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ
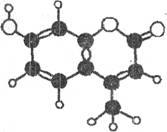
в‘ гҖҖиғҪдёҺжәҙж°ҙеҸ‘з”ҹеҸ–д»ЈеҸҚеә”В В в‘ЎиғҪдҪҝй…ёжҖ§KMn04жә¶ж¶ІиӨӘиүІВ В В в‘ў1 molиҜҘзү©иҙЁжңҖеӨҡиғҪдёҺ4 mol H2еҠ жҲҗВ в‘Ј1 molиҜҘзү©иҙЁжңҖеӨҡиғҪдёҺеҗ«2 mol NaOHзҡ„жә¶ж¶ІеҸҚеә”
AпјҺв‘ в‘Ўв‘ўВ В В В В В В В В В В В В В В В BпјҺв‘ в‘ўв‘ЈВ В В В В В В
CпјҺв‘ўв‘ЈВ В В В В В В В В В В В В В В В В В DпјҺв‘Ўв‘ўв‘Ј



