高三化学试题
2−(4−甲基苯基)−1,3−丙二醇是液晶材料的重要中间体,可以用对甲基苯乙酮为原料来合成,其合成路线流程图如下:
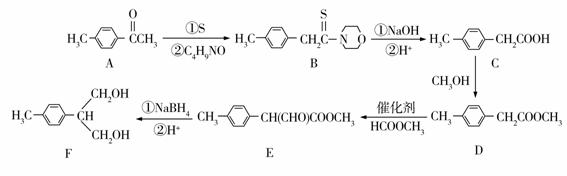
(1)E中的含氧官能团名称为 和 。
(2)实现反应C→D的方程式为 。
(3)写出一种同时满足下列条件的D的同分异构体的结构简式: 。
①含有苯环,且遇FeCl3溶液显色;
②能发生银镜反应,分子中只有5种不同化学环境的氢。
(4)A→B反应(另一种产物为水)中加入了分子式为C4H9NO的环状物质,写出其结构简式: 。
(5)乙酰乙酸乙酯(CH3COCH2COOCH2CH3 )是一种重要的有机合成原料,根据已有知识并结合相关信息,写出由乙烯制备乙酰乙酸乙酯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH。
CH3CH2OH。
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生反应的化学方程式为:5KClO3+6P=3P2O5+5KCl,则下列有关叙述错误的是( )
A.上述反应是放热反应
B.该反应氧化剂与还原剂物质的量之比为6∶5
C.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
D.上述反应中消耗3molP时,转移电子的物质的量为15mol
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时先向A中加入铁屑,B中加入较浓的NaOH溶液,打开活塞E,再从分液漏斗中加入少量6 mo1·L-1 H2SO4溶液,等一段时间后,继续加硫酸浸没F导管的下端:

(1)A中反应的离子方程式为 。
(2)实验开始时加入少量6 mo1· L-1硫酸并等待一段时间的目的是 、
。
(3)关闭E,在A装置中可观察到的现象是 。在B装置中观察到的现象是 。
(4)C装置的作用是 。
(5)拔去装置B中的橡皮塞使空气进入,写出有关的化学方程式 。
已知A、B、C、D之间的转化关系如图所示.下列说法正确的是( )
![]()
![]()
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验:
取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是 。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是 。
Ⅱ.牙膏样品中碳酸钙的定量测定:
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
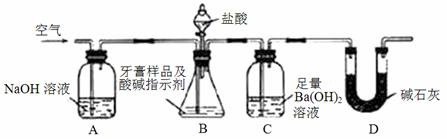
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有: 。
(4)C中反应生成BaCO3的化学方程式是 。
(5)下列各项措施中,不能提高测定准确度的是 (填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A﹣B之间增添盛有浓硫酸的洗气装置
d.在B﹣C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g,则样品中碳酸钙的质量分数为 。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是 。
H+浓度均为0.01mol/L的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是 ( )
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率小
D.盐酸和醋酸分别与锌反应的速率一样大
为检验某FeCl2溶液是否变质,可向溶液中加入 ( )
A.NaOH溶液 B.铁 C.KSCN溶液 D.石蕊溶液
A)乙烯是石化工业的重要原料,实验室是将 和浓硫酸(体积比为 )的混合液迅速加热到 的方法值得的,此反应中浓硫酸的作用是 和 ;乙烯在一定条件下发生加聚反应,其产物的名称是 ;乙烯还对水果具有 功能;乙烯能在空气中燃烧,由于乙烯的 ,所以火焰 并伴有 产生。
(B)实验室制取乙烯时常因温度过高生成少量的SO2,有人设计了下列实验以确定上述混合气体中含有乙烯和SO2。
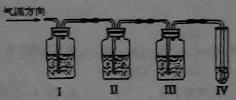
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:Ⅰ 、Ⅱ 、Ⅲ 、Ⅳ 。
(将下列有关试剂的序号填入空格内)
A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.酸性高锰酸钾溶液
(2)能说明SO2气体存在的现象是
(3)使用装置Ⅱ的目的是
(4)使用装置Ⅲ的目的是
(5)证明含有乙烯的现象是
下列各分子中,所有原子都满足最外层8电子结构的是
A. BF3 B. NCl3 C. H2O D. PCl5
某单烯烃与氢气的加成产物为:CH3CH2CH(CH3)CH2CH3 ,下列相关说法正确的是
A. 该产物的名称是2-乙基丁烷
B. 该产物有3种沸点不同的一氯代物
C. 原单烯烃只可能有3种不同结构
D. 原单烯烃与分子式为C5H10的烃一定互为同系物
100 mL含有0.20 mol·L-1碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 0.1mol·L-1 B. 0.16 mol·L-1 C. 0.24 mol·L-1 D. 0.2mol·L-1
下列操作不能达到目的的是( )
| 选项 | 目的 | 操作 |
| A | 配制100 mL1.0 mol·L-1CuSO4溶液 | 将25 g CuSO4·5H2O溶于100 mL蒸馏水中 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 在溶液中将MnO4—完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| D | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
下列说法正确的是
A.中和热测定实验中需要的玻璃仪器有:烧杯、量筒、温度计、环形玻璃搅拌棒
B.乙烯的燃烧热为1411.3 kJ·mol−1,则乙烯燃烧的热化学方程式为C2H4(g)+3O2(g)![]()
2CO2(g)+2H2O(g) ΔH=−1411.3 kJ·mol−1
C.用石墨电极电解1 L 0.1 mol·L−1 CuSO4溶液,若反应产生0.1 mol O2,则向原溶液中加入0.2 mol CuO能恢复至原浓度
D.用pH试纸分别测定氯水和盐酸的pH,比较两溶液的酸性强弱
能用![]() 来表示的化学反应是 ( )
来表示的化学反应是 ( )
A.氢氧化铁和稀盐酸反应
B.氨水和稀硫酸反应
C.氢氧化钠溶液和稀硝酸反应
D.二氧化碳通入澄清石灰水
25 ℃时,某溶液中只含有Na+、H+、OH-、A-四种离子。下列说法正确的是( )
A.对于该溶液一定存在:pH≥7
B.在c(OH-)>c(H+)的溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
C.若溶液中c(A-)=c(Na+),则溶液一定呈中性
D.若溶质为NaA,则溶液中一定存在: c(Na+)>c(A-)>c(OH-)>c(H+)
氧化镁应用广泛.以菱镁矿(主要成分为MgCO3,SiO2和FeCO3)为原料制备高纯氧化镁的实验流程如下:
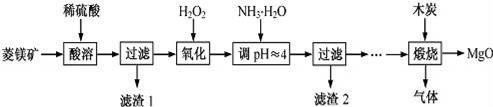
(1)MgCO3与稀硫酸反应的离子方程式为 .
(2)加入H2O2时,反应的离子方程式为 .
(3)滤渣1和滤渣2的成分别是 (填化学式) .
(4)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
①上述煅烧过程中产生的SO2用溴水吸收,离子方程式为
②得到的淡黄色固体S与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式 .
硝酸与金属反应时,浓度不同生成的还原产物也可能不同。某兴趣小组进行了如下实验探究。
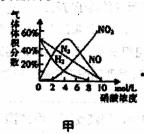
查阅资料]
a.镁与硝酸反应生成各气体产物成分及含量随HNO3浓度变化曲线如图甲所示:
b.NO2沸点:21℃;NO沸点:-151℃
c.2NO2+2OH-=NO3-+NO2-+H2O,NO+NO2+2OH-=2NO2-+H2O
实验探究] 该小组拟选用如图A B C D所示装置探究镁与4 mol·L-1硝酸反应的产物。连接装置A→B→C→D→C,检查气密性,按图示加入试剂,D中通入的O2微过量。
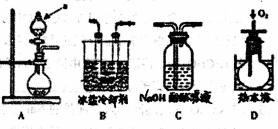
(1)第一个C装置的作用是_______,证明气体产物中有NO生成的实验现象是______。
(2)从第一个C装置中逸出的气体成分是________。
(3)溶液中还可能有一种还旅产物,这种还原产物可能是 ,请设计实验验证你的猜想 ;并写出生成该还原产物的化学方程式
有机物A的相对分子质量小于150,其中含氧的质量分数为23.5%,完全燃烧只生成二氧化碳和水。有机物之间的相互转化如图(部分反应条件略)。
请回答下列问题:
(1)H和F中含有的官能团的名称分别为:H中______________;F中________________。
(2)有机物E的结构简式为_______________________________。
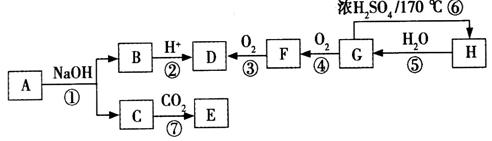
(3)有机物G能发生的反应类型有____________________(填字母)。
A.取代反应 B.加成反应 C.消去反应 D.加聚反应 E.氧化反应
(4)以M表示有机物的摩尔质量,则下列关系正确的是______________(填字母)。
A.M(A) = M(B) + M(C) B.M(D) = M(G) + 14
C.2M(F) + 18 = M(D) + M(G) D.M(D) > M(F) > M(G) > M(H)
(5)简述检验有机物F中的官能团的实验方法_______________________________________
___________________________________________________________________________________________________________________________________________________________。
(6)写出反应①的化学方程式:_______________________________________________;
写出能验证苯酚和碳酸酸性 强弱的化学反应方程式: _____________________________。
铁及其化合物在日常生活中应用广泛。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24 L(标准状况),最主要的原因是____________________________;所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因:________________________________。
(2)氧化铁是重要的工业颜料,下面是制备氧化铁的一种方法(铁屑表面常附着油污),其流程如下:
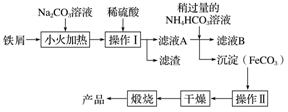
①操作Ⅰ的名称是________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________________。
②滤液A中加入稍过量的NH4HCO3溶液,生成沉淀的同时有一种气体(能使澄清石灰水变浑浊)产生,写出其化学方程式: __________________________________。
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,加酸溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,重复滴定2~3次,消耗酸性KMnO4溶液体积的平均值为20.00 mL。
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是________(填序号)。
a.硝酸 b.盐酸 c.硫酸
②上述产品中Fe2O3的质量分数为________。
下列实验中,对应的现象以及解释或结论都正确,且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 向黄色的Fe(NO)3溶 液中滴加氢碘酸 | 溶液变为紫红色 | 氧化性:Fe3+>I2 |
| B | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落下来 | 铝箔表面有致密Al2O3薄膜, A12O3且熔点高于Al |
| C | 向新收集的酸雨中滴加硝酸钡溶液 | 产生白色沉淀 | 酸雨中一定含有SO42- |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
A. A B. B C. C D. D



