й«ҳдёӯ еҢ–еӯҰ
иЎЁдёӯеҲ—еҮәдәҶзӣёе…ійҮ‘еұһзҰ»еӯҗз”ҹжҲҗж°ўж°§еҢ–зү©жІүж·Җзҡ„pHпјҲйҮ‘еұһзҰ»еӯҗзҡ„иө·е§Ӣжө“еәҰеқҮдёә0.1molВ·LпјҚ1пјү
| ж°ўж°§еҢ–зү© | FeпјҲOHпјү3 | FeпјҲOHпјү2 | CdпјҲOHпјү2 |
| ејҖе§ӢжІүж·Җзҡ„Ph | 1.5 | 6.5 | 7.2 |
| жІүж·Җе®Ңе…Ёзҡ„pH | 3.3 | 9.9 | 9.5 |
-
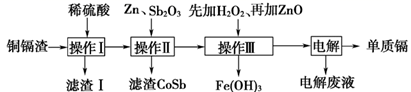
пјҲ1пјү й…ёжөёж—¶пјҢзІүзўҺй“ңй•үжёЈзҡ„зӣ®зҡ„жҳҜгҖӮ
-
пјҲ2пјү ж“ҚдҪңв… дә§з”ҹзҡ„ж»ӨжёЈв… дё»иҰҒжҲҗеҲҶдёәпјҲеЎ«еҢ–еӯҰејҸпјүгҖӮ
-
пјҲ3пјү в‘ ж“ҚдҪңв…ўдёӯе…ҲеҠ е…ҘйҖӮйҮҸH2O2 пјҢ еҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
в‘ЎеҶҚеҠ е…ҘZnOжҺ§еҲ¶еҸҚеә”ж¶Ізҡ„pHпјҢpHиҢғеӣҙдёәгҖӮ
в‘ўиӢҘеҠ е…Ҙзҡ„H2O2дёҚи¶іпјҢеҠ е…ҘZnOеҗҺжүҖеҫ—зҡ„з”өи§Јж¶Ідёӯдјҡеҗ«жңүFeе…ғзҙ гҖӮиҜ·и®ҫи®Ўе®һйӘҢж–№жЎҲеҠ д»ҘжЈҖйӘҢпјҡгҖӮ
-
пјҲ4пјү еӨ„зҗҶеҗ«й•үпјҲCd2пјӢпјүеәҹж°ҙеёёз”ЁеҠ е…ҘCaCO3е®һзҺ°жІүж·ҖиҪ¬еҢ–пјҢиӢҘеҸҚеә”иҫҫеҲ°е№іиЎЎеҗҺпјҢжә¶ж¶ІдёӯcпјҲCa2пјӢпјүпјқ0.1molВ·LпјҚ1 пјҢ жә¶ж¶ІдёӯcпјҲCd2пјӢпјүпјқmolВ·LпјҚ1[е·ІзҹҘ25в„ғпјҢKspпјҲCdCO3пјүпјқ5.6Г—10пјҚ12 пјҢ KspпјҲCaCO3пјүпјқ2.8Г—10-9]гҖӮ

-
пјҲ1пјү и°ғж•ҙеӨ©е№ійӣ¶зӮ№ж—¶пјҢиӢҘжҢҮй’ҲеҒҸеҗ‘еҸіиҫ№пјҢеә”е°Ҷе·Ұиҫ№зҡ„иһәдёқпјҲеЎ«вҖңеҗ‘е·ҰвҖқжҲ–вҖңеҗ‘еҸівҖқпјүж—ӢеҠЁпјҺ
-
пјҲ2пјү жә¶и§Јж ·е“Ғж—¶иҰҒз”ЁеҲ°зҺ»з’ғжЈ’пјҢе…¶дҪңз”ЁжҳҜпјҺ
-
пјҲ3пјү еҸҚеә”з”ҹжҲҗжІүж·Җзҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҺ
-
пјҲ4пјү еҠ зғӯи’ёеҸ‘иҝҮзЁӢдёӯиҰҒз”ЁеҲ°зҺ»з’ғжЈ’пјҢе…¶дҪңз”ЁжҳҜпјҺ
-
пјҲ5пјү иҝҮж»ӨдёӯиҰҒз”ЁеҲ°зҺ»з’ғжЈ’пјҢе…¶дҪңз”ЁжҳҜпјҺ
-
пјҲ6пјү жҙ—ж¶ӨжІүж·Җзҡ„зӣ®зҡ„жҳҜпјӣжҙ—ж¶ӨжІүж·Җзҡ„ж–№жі•жҳҜпјӣдёәдәҶжЈҖйӘҢжІүж·ҖжҳҜеҗҰжҙ—ж¶Өе№ІеҮҖпјҢеә”еңЁжңҖеҗҺдёҖж¬Ўзҡ„жҙ—ж¶Өж¶ІдёӯеҠ е…Ҙжә¶ж¶ІпјҺ
-
пјҲ7пјү иӢҘеҗ‘CuSO4жә¶ж¶Ідёӯж»ҙеҠ дәҶ 100mL NaOHжә¶ж¶ІпјҢеҲҷNaOHжә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰиҮіе°‘дёәпјҺ
 пјҢдёӢеҲ—жңүе…іиҜҘзү©иҙЁзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( )гҖӮ
пјҢдёӢеҲ—жңүе…іиҜҘзү©иҙЁзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( )гҖӮ
 еҸҜз”ЁдәҺеҲ¶йҖ зўізәізұіжқҗж–ҷпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
еҸҜз”ЁдәҺеҲ¶йҖ зўізәізұіжқҗж–ҷпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
 зҡ„ж‘©е°”иҙЁйҮҸдёә720g
C . зәізұізўіе’Ң
зҡ„ж‘©е°”иҙЁйҮҸдёә720g
C . зәізұізўіе’Ң жҳҜзўіе…ғзҙ зҡ„еҗҢзҙ ејӮеҪўдҪ“
D . зәізұізўіеұһдәҺиғ¶дҪ“
жҳҜзўіе…ғзҙ зҡ„еҗҢзҙ ејӮеҪўдҪ“
D . зәізұізўіеұһдәҺиғ¶дҪ“
-
пјҲ1пјү еңЁ80 в„ғж—¶пјҢе°Ҷ0.40 mol зҡ„N2O4ж°”дҪ“е……е…Ҙ2 L е·Із»ҸжҠҪз©әзҡ„еӣәе®ҡе®№з§Ҝзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡN2O4
 2NO2 О”H>0пјҢйҡ”дёҖж®өж—¶й—ҙеҜ№иҜҘе®№еҷЁеҶ…зҡ„зү©иҙЁиҝӣиЎҢеҲҶжһҗпјҢеҫ—еҲ°еҰӮдёӢж•°жҚ®пјҡ
2NO2 О”H>0пјҢйҡ”дёҖж®өж—¶й—ҙеҜ№иҜҘе®№еҷЁеҶ…зҡ„зү©иҙЁиҝӣиЎҢеҲҶжһҗпјҢеҫ—еҲ°еҰӮдёӢж•°жҚ®пјҡ ж—¶й—ҙ/s
зү©иҙЁ n/mol
0
20
40
60
80
100
n(N2O4)
0.40
a
0.20
c
d
e
n(NO2)
0.00
0.24
b
0.52
0.60
0.60
в‘ и®Ўз®—20~40 s еҶ…з”ЁN2O4иЎЁзӨәзҡ„е№іеқҮеҸҚеә”йҖҹзҺҮдёә molВ·L-1В·s-1.
в‘Ўи®Ўз®—еңЁ80 в„ғж—¶иҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°K=гҖӮ
в‘ўеҸҚеә”иҝӣиЎҢиҮі100 s еҗҺе°ҶеҸҚеә”ж··еҗҲзү©зҡ„жё©еәҰйҷҚдҪҺпјҢж··еҗҲж°”дҪ“зҡ„йўңиүІ(еЎ«вҖңеҸҳжө…вҖқвҖңеҸҳж·ұвҖқжҲ–вҖңдёҚеҸҳвҖқ)гҖӮ
в‘ЈиҰҒеўһеӨ§иҜҘеҸҚеә”зҡ„KеҖјпјҢеҸҜйҮҮеҸ–зҡ„жҺӘж–Ҫжңү(еЎ«еәҸеҸ·)гҖӮ
AпјҺеўһеӨ§N2O4иө·е§Ӣжө“еәҰ BпјҺеҗ‘ж··еҗҲж°”дҪ“дёӯйҖҡе…ҘNO2
CпјҺдҪҝз”Ёй«ҳж•ҲеӮ¬еҢ–еүӮ DпјҺеҚҮй«ҳжё©еәҰ
-
пјҲ2пјү T в„ғж—¶пјҢAж°”дҪ“дёҺBж°”дҪ“еҸҚеә”з”ҹжҲҗCж°”дҪ“пјҢеҸҚеә”иҝҮзЁӢдёӯAгҖҒBгҖҒCжө“еәҰеҸҳеҢ–еҰӮеӣҫ(в… )жүҖзӨәпјҢиӢҘдҝқжҢҒе…¶д»–жқЎд»¶дёҚеҸҳпјҢжё©еәҰеҲҶеҲ«дёәT1е’ҢT2ж—¶пјҢBзҡ„дҪ“з§ҜеҲҶж•°дёҺж—¶й—ҙзҡ„е…ізі»еҰӮеӣҫ(в…Ў)жүҖзӨәгҖӮ
 (в… )
(в… ) 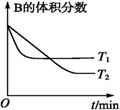 (в…Ў)
(в…Ў)ж №жҚ®д»ҘдёҠжқЎд»¶пјҢеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
в‘ AдёҺBеҸҚеә”з”ҹжҲҗCзҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҢжӯЈеҸҚеә”дёә(еЎ«вҖңеҗёзғӯвҖқжҲ–вҖңж”ҫзғӯвҖқ)еҸҚеә”гҖӮ
в‘Ўt1 minеҗҺпјҢж”№еҸҳдёӢеҲ—жҹҗдёҖжқЎд»¶пјҢиғҪдҪҝе№іиЎЎеҗ‘йҖҶеҸҚеә”ж–№еҗ‘移еҠЁзҡ„жңү(еЎ«еӯ—жҜҚзј–еҸ·)гҖӮ
AпјҺдҝқжҢҒе…¶д»–жқЎд»¶дёҚеҸҳпјҢеўһеӨ§еҺӢејә
BпјҺдҝқжҢҒе®№еҷЁжҖ»дҪ“з§ҜдёҚеҸҳпјҢйҖҡе…Ҙе°‘йҮҸзЁҖжңүж°”дҪ“
CпјҺдҝқжҢҒе…¶д»–жқЎд»¶дёҚеҸҳпјҢеҚҮй«ҳжё©еәҰ
-
пјҲ3пјү е·ІзҹҘ2A2(g)+B2(g)
 2C(g) О”H=-a kJВ·mol-1(a>0)пјҢеңЁдёҖдёӘжңүеӮ¬еҢ–еүӮзҡ„еӣәе®ҡе®№з§Ҝзҡ„е®№еҷЁдёӯеҠ е…Ҙ2 mol A2е’Ң1 mol B2 пјҢ еңЁ500 в„ғж—¶е……еҲҶеҸҚеә”иҫҫеҲ°е№іиЎЎеҗҺCзҡ„жө“еәҰдёәw molВ·L-1 пјҢ ж”ҫеҮәзғӯйҮҸb kJгҖӮ
2C(g) О”H=-a kJВ·mol-1(a>0)пјҢеңЁдёҖдёӘжңүеӮ¬еҢ–еүӮзҡ„еӣәе®ҡе®№з§Ҝзҡ„е®№еҷЁдёӯеҠ е…Ҙ2 mol A2е’Ң1 mol B2 пјҢ еңЁ500 в„ғж—¶е……еҲҶеҸҚеә”иҫҫеҲ°е№іиЎЎеҗҺCзҡ„жө“еәҰдёәw molВ·L-1 пјҢ ж”ҫеҮәзғӯйҮҸb kJгҖӮ в‘ a(еЎ«вҖң>вҖқвҖң=вҖқжҲ–вҖң<вҖқ)bгҖӮ
в‘ЎиӢҘе°ҶеҸҚеә”жё©еәҰеҚҮй«ҳеҲ°700 в„ғпјҢиҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°е°Ҷ(еЎ«вҖңеўһеӨ§вҖқвҖңеҮҸе°ҸвҖқжҲ–вҖңдёҚеҸҳвҖқ)гҖӮ
в‘ўиӢҘеңЁеҺҹжқҘзҡ„е®№еҷЁдёӯпјҢеҸӘеҠ е…Ҙ2 mol CпјҢ500 в„ғж—¶е……еҲҶеҸҚеә”иҫҫеҲ°е№іиЎЎеҗҺпјҢеҗёж”¶зғӯйҮҸc kJпјҢCзҡ„жө“еәҰ(еЎ«вҖң>вҖқвҖң=вҖқжҲ–вҖң<вҖқ)w molВ·L-1.
в‘ЈиғҪиҜҙжҳҺиҜҘеҸҚеә”е·Із»ҸиҫҫеҲ°е№іиЎЎзҠ¶жҖҒзҡ„жҳҜгҖӮ
a.v(C)=2v(B2) b.е®№еҷЁеҶ…еҺӢејәдҝқжҢҒдёҚеҸҳ
c.vйҖҶ(A2)=2vжӯЈ(B2) d.е®№еҷЁеҶ…ж°”дҪ“зҡ„еҜҶеәҰдҝқжҢҒдёҚеҸҳ
в‘ӨдҪҝиҜҘеҸҚеә”зҡ„еҸҚеә”йҖҹзҺҮеўһеӨ§пјҢдё”е№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁзҡ„ж“ҚдҪңжҳҜгҖӮ
a.еҸҠж—¶еҲҶзҰ»еҮәCж°”дҪ“ b.йҖӮеҪ“еҚҮй«ҳжё©еәҰ
c.еўһеӨ§B2зҡ„жө“еәҰ d.йҖүжӢ©й«ҳж•Ҳзҡ„еӮ¬еҢ–еүӮ
A | B | C | D |
|
вҖң马иёҸйЈһзҮ•вҖқй“ңеҘ”马 |
е®ҮиҲӘе‘ҳзҡ„иҲӘеӨ©жңҚ |
е…үеҜјзәӨз»ҙ |
ж— жңәйқһйҮ‘еұһжқҗж–ҷ | йҮ‘еұһжқҗж–ҷ | жңүжңәй«ҳеҲҶеӯҗжқҗж–ҷ | еӨҚеҗҲжқҗж–ҷ |
зӯүиҙЁйҮҸзҡ„SO2е’ҢSO3 дёӯпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В В В пјү
гҖҖгҖҖгҖҖAпјҺжүҖеҗ«ж°§еҺҹеӯҗзҡ„дёӘж•°жҜ”дёә2вҲ¶3гҖҖгҖҖгҖҖBпјҺжүҖеҗ«зЎ«еҺҹеӯҗзҡ„дёӘж•°жҜ”дёә1вҲ¶1
гҖҖгҖҖгҖҖCпјҺжүҖеҗ«ж°§е…ғзҙ зҡ„иҙЁйҮҸжҜ”дёә5вҲ¶6гҖҖгҖҖгҖҖDпјҺжүҖеҗ«зЎ«е…ғзҙ зҡ„иҙЁйҮҸжҜ”дёә5вҲ¶4
дҫқжҚ®е…ғзҙ е‘ЁжңҹиЎЁеҸҠе…ғзҙ е‘ЁжңҹеҫӢпјҢдёӢеҲ—жҺЁж–ӯжӯЈзЎ®зҡ„жҳҜ
A.Mg(OH)2зҡ„зўұжҖ§жҜ”Be(OH)2зҡ„ејұ
B.H3BO3зҡ„й…ёжҖ§жҜ”H2CO3зҡ„ејұ
C.HClгҖҒHBrгҖҒHIзҡ„зғӯзЁіе®ҡжҖ§дҫқж¬Ўеўһејә
D.иӢҘMпјӢе’ҢR2пјҚзҡ„ж ёеӨ–з”өеӯҗеұӮз»“жһ„зӣёеҗҢпјҢеҲҷеҺҹеӯҗеәҸж•°пјҡR>M
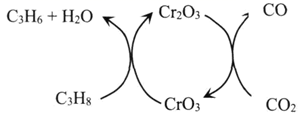
жҹҗеҗ«й“¬жұЎжіҘдё»иҰҒеҗ«Cr2O3гҖҒAl2O3гҖҒFe2O3зӯүзү©иҙЁпјҢиҜҘжұЎжіҘеҸҜд»Ҙз”Ёж№ҝжі•еӣһ收еҲ©з”ЁпјҢжөҒзЁӢеҰӮдёӢеӣҫжүҖзӨәпјҡ
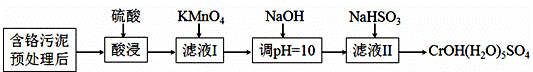
е·ІзҹҘпјҡе®Өжё©дёӢйғЁеҲҶж°ўж°§еҢ–зү©зҡ„Kspи§ҒдёӢиЎЁ
| Al(OH)3 | Fe(OH)3 | Cr(OH)3 | Mn(OH)2 | |
| Ksp | 3Г—10-34 | 4Г—10-38 | 6Г—10-31 | 4Г—10-14 |
пјҲ1пјүй…ёжөёеүҚпјҢеҜ№еҗ«й“¬жұЎжіҘиҝӣиЎҢйў„еӨ„зҗҶеҚіеҠ ж°ҙж№ҝзЈЁжҲҗжөҶдҪ“пјҢж№ҝзЈЁзҡ„дҪңз”ЁжҳҜ_____________гҖӮ
пјҲ2пјүеҗ‘ж»Өж¶ІIеҠ KMnO4ж°§еҢ–Cr3+зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜ________________________________;е°ҶCr3+ж°§еҢ–зҡ„зӣ®зҡ„жҳҜ____________________________________________________гҖӮ
пјҲ3пјүе®Өжё©дёӢпјҢи°ғpH=10ж—¶пјҢ ![]() =_____пјӣи°ғжә¶ж¶ІpHдёҚиғҪеӨ§дәҺ10пјҢзҗҶз”ұжҳҜ_________гҖӮ
=_____пјӣи°ғжә¶ж¶ІpHдёҚиғҪеӨ§дәҺ10пјҢзҗҶз”ұжҳҜ_________гҖӮ
пјҲ4пјүNaHSO3еңЁеҸҚеә”дёӯзҡ„дҪңз”ЁжҳҜ___________пјӣзҗҶи®әдёҠn (NaHSO3):n[CrOH(H2O)5SO4]д№ӢжҜ”жҳҜ_______________гҖӮ
пјҲ5пјүNaHSO3еӣәдҪ“еңЁз©әж°”дёӯжҳ“еҸҳиҙЁпјҢеҶҷеҮәжЈҖйӘҢNaHSO3жҳҜеҗҰеҸҳиҙЁзҡ„ж–№жі•______________гҖӮ
еҸӨиҖҒдҪҶд»Қ然жҳҜжңҖжңүз”Ёзҡ„еҲ¶еӨҮиҒ”ж°Ё(N2H4)жә¶ж¶Ізҡ„ж–№жі•еҰӮдёӢпјҡ
В В В NaClO+В В В NH3В·H2O ![]() В В В В N2H4 +В В В NaCl+В В В H2O
В В В В N2H4 +В В В NaCl+В В В H2O
пјҲ1пјүиҜ·й…Қе№ідёҠиҝ°еҢ–еӯҰж–№зЁӢејҸгҖӮ并用еҚ•зәҝжЎҘжі•ж ҮеҮәз”өеӯҗиҪ¬з§»зҡ„ж–№еҗ‘е’Ңж•°зӣ®гҖӮ
пјҲ2пјүNH3В·H2OеңЁдёҠиҝ°еҸҚеә”дёӯжҳҫзӨәеҮәжқҘзҡ„жҖ§иҙЁжҳҜВ В В В В В В В В В В В В В В В гҖӮ
AпјҺж°§еҢ–жҖ§В В В В В В В BпјҺиҝҳеҺҹжҖ§В В В В В В CпјҺй…ёжҖ§В В В В В В DпјҺзўұжҖ§
пјҲ3пјүиҜҘеҸҚеә”зҡ„ж°§еҢ–дә§зү©жҳҜВ В В В В В В В В В В В пјҢNaClOеҸ‘з”ҹВ В В В В В В В В В В В еҸҚеә”гҖӮ
пјҲ4пјүиӢҘз”ҹжҲҗ 0.2 mol N2H4пјҢеҲҷиҪ¬з§»зҡ„з”өеӯҗдёәВ В В В В В В В В В В В В В В В molгҖӮ
1molжҹҗзғғиғҪдёҺ2molHClе®Ңе…ЁеҠ жҲҗпјҢе…¶дә§зү©жңҖеӨҡиғҪиў«8molCl2е®Ңе…ЁеҸ–д»ЈпјҢеҲҷеҺҹзғғдёҚеҸҜиғҪдёәпјҲВ пјү
AпјҺ1,3-дёҒдәҢзғҜВ В BпјҺзҺҜдёҒдәҢзғҜВ В CпјҺ2-дёҒзӮ”В DпјҺ1-дёҒзӮ”
пјҲ1пјүжңүжңәзү©A  зҡ„зі»з»ҹе‘ҪеҗҚжі•е‘ҪеҗҚдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҢВ В В иҜҘзғғзҡ„дёҖж°Ҝд»Јзү©е…·жңүжңү________з§ҚгҖӮ
зҡ„зі»з»ҹе‘ҪеҗҚжі•е‘ҪеҗҚдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҢВ В В иҜҘзғғзҡ„дёҖж°Ҝд»Јзү©е…·жңүжңү________з§ҚгҖӮ
пјҲ2пјүжңүжңәзү©BеҸҜз”ұи‘Ўиҗ„зі–еҸ‘й…өеҫ—еҲ°пјҢд№ҹеҸҜд»Һй…ёзүӣеҘ¶дёӯжҸҗеҸ–гҖӮзәҜеҮҖзҡ„Bдёәж— иүІй»ҸзЁ ж¶ІдҪ“пјҢжҳ“жә¶дәҺж°ҙгҖӮдёәз ”з©¶Bзҡ„з»„жҲҗдёҺз»“жһ„пјҢиҝӣиЎҢдәҶеҰӮдёӢе®һйӘҢпјҡ
| е®һйӘҢжӯҘйӘӨ | и§ЈйҮҠжҲ–е®һйӘҢз»“и®ә |
| (1)з§°еҸ–B9.0 gпјҢеҚҮжё©дҪҝе…¶жұҪеҢ–пјҢжөӢе…¶еҜҶеәҰжҳҜзӣёеҗҢжқЎд»¶дёӢH2зҡ„45еҖҚ | иҜ•йҖҡиҝҮи®Ўз®—еЎ«з©әпјҡ (1)Bзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёәВ В В В В В В В В |
| (2)е°ҶжӯӨ9.0 g BеңЁи¶ійҮҸзәҜO2дёӯе……еҲҶзҮғзғ§пјҢ并дҪҝе…¶дә§зү©дҫқж¬Ўзј“зј“йҖҡиҝҮжө“зЎ«й…ёгҖҒзўұзҹізҒ°пјҢеҸ‘зҺ°дёӨиҖ…еҲҶеҲ«еўһйҮҚ5.4 gе’Ң13.2 g | пјҲ2пјүBзҡ„е®һйӘҢејҸдёә________В В В В В пјҲ3пјүBзҡ„еҲҶеӯҗејҸдёә__________В В В В В |
дёӢиЎЁеҗ„з»„зү©иҙЁд№Ӣй—ҙдёҚиғҪйҖҡиҝҮдёҖжӯҘеҸҚеә”е®һзҺ°еҰӮеӣҫ1жүҖзӨәиҪ¬еҢ–е…ізі»зҡ„жҳҜ
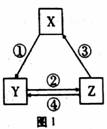
| йҖүйЎ№ | X | Y | Z | еҜ№еә”з®ӯеӨҙдёҠжүҖж Үж•°еӯ—зҡ„еҸҚеә”иҜ•еүӮ |
| A | Fe | FeCl3 | FeCl2 | в‘ в‘ЈеҸҜз”ЁзӣёеҗҢиҜ•еүӮ |
| B | Al2O3 | NaAlO2 | Al(OH)3 | еҠ ж°Ёж°ҙ |
| C | NO | NO2 | HNO3 | в‘Ўж°”дҪ“йҖҡе…Ҙж°ҙдёӯ |
| D | Cl2 | HClO | NaClO | в‘ўеҠ жө“зӣҗй…ё |
еёёжё©дёӢ0.1 molВ·LпјҚ1жҹҗдёҖе…ғй…ёпјҲHAпјүжә¶ж¶Ідёӯ![]() пјқ1Г—10пјҚ8пјҢдёӢеҲ—еҸҷиҝ°жӯЈ
пјқ1Г—10пјҚ8пјҢдёӢеҲ—еҸҷиҝ°жӯЈ
зЎ®зҡ„жҳҜпјҲВ В В пјү
AпјҺиҜҘжә¶ж¶Ідёӯз”ұж°ҙз”өзҰ»еҮәзҡ„c(H+)пјқ1Г—10пјҚ11 molВ·LпјҚ1
BпјҺжө“еәҰеқҮдёә0.1mol/Lзҡ„HAе’ҢNaAжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲеҗҺпјҢиӢҘжә¶ж¶Іе‘Ҳй…ёжҖ§пјҢ
еҲҷc(AвҖ”)пјһc(HA)пјһc(Na+)пјһc(H+)пјһc(OHвҖ”)
CпјҺ0.1 molВ·LпјҚ1HAжә¶ж¶ІдёҺ0.05 molВ·LпјҚ1 NaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲеҗҺжүҖеҫ—жә¶ж¶Ідёӯ
2c(H+)+ c(HA) пјқ c(AвҖ”) + 2c(OHвҖ”)
DпјҺ0.1 molВ·LпјҚ1HAжә¶ж¶ІдёҺ0.05 molВ·LпјҚ1 NaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲеҗҺжүҖеҫ—жә¶ж¶Ідёӯ
c(AвҖ”) + c(HA) пјқ c(Na+)
дёҖе®ҡжё©еәҰдёӢеңЁе®№з§ҜжҒ’е®ҡзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢиҝӣиЎҢеҸҜйҖҶеҸҚеә”: A(s)+2B(g)![]() C(g)+D(g)пјҢеҪ“дёӢеҲ—зү©зҗҶйҮҸдёҚеҸ‘з”ҹеҸҳеҢ–ж—¶пјҢиғҪиЎЁжҳҺиҜҘеҸҚеә”е·ІиҫҫеҲ°иҜҘжқЎд»¶дёӢзҡ„жңҖеӨ§йҷҗеәҰзҡ„жҳҜ
C(g)+D(g)пјҢеҪ“дёӢеҲ—зү©зҗҶйҮҸдёҚеҸ‘з”ҹеҸҳеҢ–ж—¶пјҢиғҪиЎЁжҳҺиҜҘеҸҚеә”е·ІиҫҫеҲ°иҜҘжқЎд»¶дёӢзҡ„жңҖеӨ§йҷҗеәҰзҡ„жҳҜ
в‘ е®№еҷЁеҶ…ж°”дҪ“зҡ„еҺӢејәВ В В В В В В В В В В В В В В В в‘Ўж··еҗҲж°”дҪ“зҡ„еҜҶеәҰ
в‘ўж··еҗҲж°”дҪ“зҡ„е№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸВ В В В В В в‘ЈBзҡ„зү©иҙЁзҡ„йҮҸ
AпјҺеҸӘжңүв‘ЈВ В В В В В В В В В В В В В В В В В В В В гҖҖВ BпјҺв‘Ўв‘ўВ В В В В В В В В В В
CпјҺв‘Ўв‘ўв‘ЈВ В В В В В В В В В В В В В В В В В В В В гҖҖВ DпјҺв‘ в‘Ј
 дәәйқўйұјзә№йҷ¶зӣҶ
дәәйқўйұјзә№йҷ¶зӣҶ





