高中 化学
 C(气)+D(气)已达到平衡状态的是( )
C(气)+D(气)已达到平衡状态的是( )
____Cr2O  +____Cl﹣+____H+=____Cl2↑+____Cr3++____□,下列有关叙述不正确的是( )
+____Cl﹣+____H+=____Cl2↑+____Cr3++____□,下列有关叙述不正确的是( )
 参加反应,产生氯气物质的量是0.5mol
参加反应,产生氯气物质的量是0.5mol
 溶液中加入过量的氨水:
溶液中加入过量的氨水: 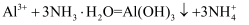 B . 将CuO溶于过量的氨水中:
B . 将CuO溶于过量的氨水中: 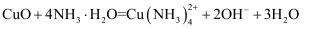 C . 向饱和
C . 向饱和  溶液中通入
溶液中通入  :
:  D .
D .  溶液中加入足量的氢氧化钡(偏铝酸钡可溶):
溶液中加入足量的氢氧化钡(偏铝酸钡可溶): 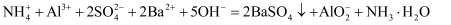
-
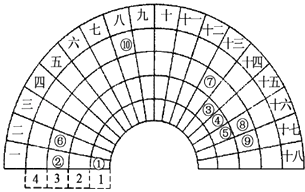
(1) 上述十种物质中,属于电解质的有(填序号),属于非电解质的有(填序号)
-
(2) 除去③中少量②的操作是,化学方程式为;
-
(3) 现有100mL溶液中含Fe3+5.6g,则溶液中
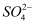 的物质的量浓度是;
的物质的量浓度是;
-
(4) 若在⑦中缓慢加入①的水溶液,产生的现象是。
 C . 与同周期的53I的原子半径:Sr>I
D . 最高价氧化物对应的水化物的碱性:Ca(OH)2>Sr(OH)2
C . 与同周期的53I的原子半径:Sr>I
D . 最高价氧化物对应的水化物的碱性:Ca(OH)2>Sr(OH)2
⑵C(s)+O2(g)=CO2(g △H2
⑶2H2(g)+O2(g)=2H2O(l) △H3
⑷2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l) △H4
⑸2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H5
下列关于上述反应的焓变的判断正确的是( )
 + H2O⇌H2CO3+ OH-
C . NH3·H2O⇌NH
+ H2O⇌H2CO3+ OH-
C . NH3·H2O⇌NH  + OH-
D . HCO
+ OH-
D . HCO  + H2O⇌CO
+ H2O⇌CO 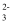 + H3O+
+ H3O+
一些易燃易爆化学试剂的瓶子上贴有“危险”警告标签以警示使用者。下面是一些危险警告标签,则实验室对盛装苯酚的试剂瓶应贴上的标签是( )

A.①③ B.②③
C.②④ D.①④
有温度、容积相同的甲、乙两个密闭容器。往甲容器中通入1g N2和1g H2,乙容器中通入2g N2和2g H2,保持恒温、恒容达到平衡,相关参数比较正确的是
A.平衡时N2的转化率:α甲>2α乙 B.平衡时NH3的浓度:2c甲<c乙
C.平衡时体系压强:2p甲>p乙 D.反应放出的热量:2Q甲>Q
某实验室需要配制480mL 0.10 mol/L Na2CO3溶液。
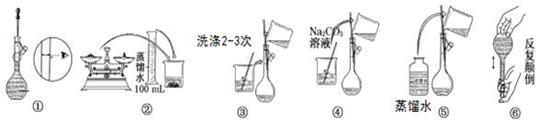
(1)所需玻璃仪器有:玻璃棒、烧杯、100mL量筒、胶头滴管、 ![]() 。
。
(2)实验时图中所示操作的先后顺序为 (填编号)
(3)在配制过程中,下列操作对所配溶液浓度有无影响?(填“偏高”、“偏低”或“无影响”)
①转移溶液后没有洗涤烧杯和玻璃棒 。
②向容量瓶加水定容时俯视液面 。
③摇匀后液面下![]() 降,再加水至刻度线 。
降,再加水至刻度线 。
④使用前容量瓶用蒸馏水洗涤,且没有干燥 。
(4)所需Na2CO3固体的质量为 g;若改用浓溶液稀释,需要量取2 mol/L Na2CO3溶液 ml。
某有机物和足量的银氨溶液在微热下发生反应,生成10.8g Ag,而燃烧等量的有机物时,需消耗氧气6.16L(标准状况),则该有机物是( )
A.葡萄糖 B.乙酸甲酯
C.丁醛 D.乙醛
已知: 乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3) 的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。
回答下列问题:
(1) 写出水溶液中草酸的第一步电离方程式________________________。
(2) 相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH 比Na2CO3溶液的pH_____(填“大”、“小”或“相等”)。
(3) 常温下将0.4mol/L 的KOH 溶液20mL 与0.2mol/L 的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为___________________________。
(4) 往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为_______________________。
(5) 25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmolL的草酸钾溶液20mL后,有草酸钙沉淀生成,则c 的最小值为____________。
1.76g铜镁合金完全溶解于50mL、密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2气体1792 mL(标准状况),向反应后的溶液中加入适量的1.0mol/L氢氧化钠溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是:
A.该浓硝酸中硝酸的物质的量浓度是14.0mol/L
B.加入NaOH溶液的体积是50mL
C.浓硝酸在与合金反应中表现酸性和氧化性,且起氧化性的硝酸的物质的量为0.08 mol
D.得到的金属氢氧化物的沉淀为3.12g
“锂-空气电池”能量密度极高、成本较低,其工作原理如图所示,电极反应为:4Li+O2+2H2O=4LiOH。下列说法不正确的是
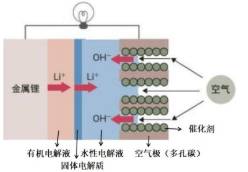
A. 锂电极上发生氧化反应
B. 空气极(多孔碳)上的电极反应式:O2+4e-+4H+=2H2O
C. 电池工作时,电流由多孔碳电极经导线流向金属锂电极,再经有机电解液和水性电解液流向多孔碳电极
D. 若外电路中流过0.02mol电子,负极材料减重0.14g
Yohiaki Nakao报道 (b)在Pd催化下可发生Buchwald-Hartwig偶联反应。下列说法不可确的是
(b)在Pd催化下可发生Buchwald-Hartwig偶联反应。下列说法不可确的是
A.b的分子式为C18H12N2O2
B.b的一氯代物有4种
C.b可发生取代反应
D.b的所有原子不一定共平面



