江西省赣州市2021-2022学年高一上学期第二次月考化学试卷
| 1. 难度:简单 | 详细信息 |
| 下列化学药品名称与警示标志对应正确的是( ) A.酒精 |
|
| 2. 难度:简单 | 详细信息 |
| 将下列各组物质按酸、碱、盐分类顺序排列,正确的是( ) A.硫酸,纯碱,石灰石 B.醋酸,烧碱,硫酸铜 C.磷酸,熟石灰,苛性钠 D.醋酸,小苏打,熟石灰 |
|
| 3. 难度:中等 | 详细信息 |
| 下列关于实验基本操作的叙述不正确的是( ) A.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 C.将浓硫酸倒入盛水的量筒中稀释成稀硫酸 D.使用容量瓶、分液漏斗前,先检查是否漏水后洗涤干净 |
|
| 4. 难度:简单 | 详细信息 |
| 同温同压下,同体积的甲乙两种气体的质量比是17:14。若乙气体是CO,则甲气体是 A. H2S B. HCl C. NH3 D. Cl2 |
|
| 5. 难度:中等 | 详细信息 |
| NA表示阿伏加德罗常数,则下列说法正确的是( ) A.0.1 mol/L K2SO4溶液含有K+ 0.2NA B.标准状况下,11.2L水所含的电子数为5NA C.常温常压下,16g O2含电子数为10NA D.0.1 mol Mg原子变成Mg2+时失去的电子数为0.2NA |
|
| 6. 难度:中等 | 详细信息 |
| 配制一定体积、一定物质的量浓度的溶液时,下列操作会使得所配溶液的浓度偏小的是( ) A.容量瓶中原有少量蒸馏水 B.定容时俯视容量瓶刻度线 C.滴管加水时,有少量水滴到容量瓶外 D.溶液从烧杯转移到容量瓶后没有洗涤烧杯 |
|
| 7. 难度:简单 | 详细信息 |
| 在Na2SO4和Al2(SO4)3混合溶液中,测得Al3+浓度为0.1mol/L,SO42-浓度为0.3mol/L,则混合溶液中Na+的浓度为( ) A. 0.15mol/L B. 0.45mol/L C. 0.6mol/L D. 0.3mol/L |
|
| 8. 难度:中等 | 详细信息 |
| 下列各物质中所含原子个数由大到小的顺序正确的是( ) ①0.3molNH3 ②标准状况下22.4L氯气 ③9mL H2O (4℃) ④0.2mol H3PO4 A.①④③② B.④③②① C.②④③① D.①④②③ |
|
| 9. 难度:中等 | 详细信息 |
| 下列关于溶液和胶体的叙述,正确的是( ) A. 溶液是电中性的,胶体是带电的 B. 通电时,溶液中的溶质粒子不移动,胶体中的分散质粒子向某一极移动 C. 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 D. 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
|
| 10. 难度:简单 | 详细信息 |
| 用焰色反应检验K+时有如下操作步骤:①蘸取待测液,②置于酒精灯火焰上灼烧,③透过蓝色钴玻璃观察,④用稀盐酸洗净铂丝。其中正确的操作顺序为( ) A.①②③④ B.④①②③ C.④②①②③ D.①③②④ |
|
| 11. 难度:中等 | 详细信息 |
| 下列反应的离子方程式书写正确的是( ) A.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ B.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑ D.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
|
| 12. 难度:简单 | 详细信息 |
| 下列各组离子能大量共存的是( ) A.Ca2+、HCO3-、K+、NO3- B.HCO3-、H+、Ba2+、Na+ C.HCO3-、OH-、Al3+、Na+ D.Mg2+、Fe3+、OH-、Cl- |
|
| 13. 难度:困难 | 详细信息 |
| 下列变化不可能通过一步实验直接完成的是 A. Fe(OH)3 → Fe2O3 B. Fe2O3 → Fe(OH)3 C. Al → Al3+ D. Al3+ → AlO2- |
|
| 14. 难度:中等 | 详细信息 |
| 将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中铁、铝物质的量之比为( ) A.3∶2 B.2∶1 C.3∶4 D.4∶3 |
|
| 15. 难度:中等 | 详细信息 |
| 把16 g甲烷(CH4)在64 g氧气中完全燃烧后的产物通入足量的过氧化钠后,过氧化钠增加的质量为 A.48 g B.16 g C.80 g D.32 g |
|
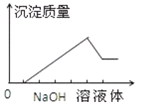
| 16. 难度:中等 | 详细信息 |
| 在某无色溶液中缓慢地滴入 NaOH溶液直至过量,产生沉淀的质量与加入的 NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
A. Mg2+、Al3+、Fe3+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. 只有 Mg2+、Al3+ |
|
| 17. 难度:中等 | 详细信息 |
| 下列混合物的分离或提纯,应选用下述方法的哪一种?(填序号) A、分液 B、过滤 C、萃取 D、蒸馏 E、升华 F、灼热氧化 G、降温结晶 H、加热分解 (1)除去澄清石灰水中悬浮的CaCO3:________; (2)分离植物油和水________; (3)分离酒精和水的混合物:________; (4)从碘水中提取碘________; (5)除去NaCl中所含的少量KNO3________; (6)除去固体 KCl中少量 KClO3________; (7)除去NaCl晶体中混有的少量I2________; (8)除去二氧化碳气体中混有的少量氧气________。 |
|
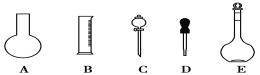
| 18. 难度:中等 | 详细信息 |
| 实验室需要0.3 mol·L-1 NaOH溶液480 mL和一定浓度的硫酸溶液。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是___(填序号),配制上述溶液还需用到的玻璃仪器是___(填仪器名称)。 (2)在配制NaOH溶液时: ①根据计算用托盘天平称取NaOH的质量为________g; ②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________(填“>”、“<”或“=”)0.3 mol·L-1。 (3)实验室采购了98%(ρ=1.84g•cm﹣3)的硫酸配制3.68mol•L﹣1的硫酸溶液500mL,需准确量取98%的硫酸_____mL; (4)该同学实际配制硫酸溶液的浓度为3.50 mol·L-1,原因可能是___________(填序号)。 A.用胶头滴管加水时俯视刻度 B.容量瓶中原来存有少量水 C.稀释硫酸的烧杯,溶液转移后未洗涤 D.用胶头滴管加水定容时仰视刻度 (5)若在滴加蒸馏水时,不慎超过了刻度线,此时应如何处理?______________。 |
|
| 19. 难度:中等 | 详细信息 |
| 有4种钠的化合物W、X、Y、Z,它们之间存在如下关系: ①W ③Z+H2O→Y+O2↑ ④X+Ca(OH)2→Y+CaCO3↓ 试回答下列问题: (1)W、X、Y、Z的化学式分别是W__________、X__________、Y__________、Z__________。 (2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中的氧化剂是____________(写化学式),还原剂是____________(写化学式)。 (3)若反应④在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式: ①离子方程式:________________。 ②化学方程式:__________________。
|
|
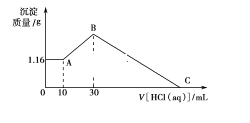
| 20. 难度:中等 | 详细信息 |
| 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的悬浊液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示,试回答:
(1)A点→B点反应的离子方程式为____________________________________。 (2)原混合物中AlCl3的物质的量为________________,NaOH的物质的量为___________________。 (3)HCl溶液在C点的加入量是_______________________。
|
|