冲刺2021高考化学押题训练(三)氧化还原反应
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-04-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
用来解释下列事实的方程式错误的是( )
A . 钢铁发生吸氧腐蚀的正极反应:O2+4e-+2H2O=4OH-
B . 将氯气通入石灰乳制备漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C . 向Na2SiO3溶液中通过量CO2制备硅酸凝胶:SiO32-+2CO2+2H2O=H2SiO3+2HCO3-
D . 溶质物质的量比为1:1的明矾溶液和Ba(OH)2溶液混合:2SO42-+2Ba2++Al3++4OH-=AlO2-+2BaSO4↓+2H2O
|
|
| 2. 综合题 | |||||||||||||||||||||||
|
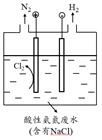
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
|
|||||||||||||||||||||||
| 3. 单选题 | |
|
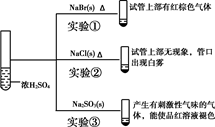
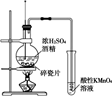
向浓硫酸中分别加入下列三种固体,对实验现象的分析正确的是( )
A . 对比实验①和②可知还原性:Br->Cl-
B . 对比实验①和③可知氧化性:Br2>SO2
C . 对比实验②和③可知酸性:H2SO4>HCl>H2SO3
D . 由实验可知浓硫酸具有强酸性、难挥发性、氧化性、脱水性
|
|
| 4. 单选题 | |
|
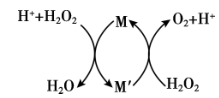
常温下,向H2O2溶液中滴加少量Fe2(SO4)3溶液,反应原理如图所示。关于该反应过程的说法正确的是( )
A . 该反应过程中,M是Fe3+ , M′是Fe2+
B . 当有1molO2生成时,转移2mo1电子
C . 在H2O2分解过程中,溶液的pH逐渐降低
D . H2O2的氧化性比Fe3+强,还原性比Fe2+弱
|
|
| 5. 单选题 | |||||||||||||||||||||
|
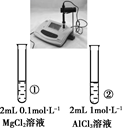
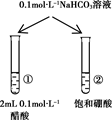
下列实验的现象与结论相对应的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 6. 综合题 | |
|
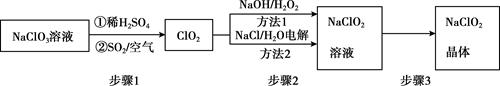
2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(ClO2)就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为NaClO2保存。分别利用吸收法和电解法两种方法得到较稳定的NaClO2。其工艺流程示意图如图所示:
已知:①纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。 ②长期放置或高于60℃时NaClO2易分解生成NaClO3和NaCl
|
|
| 7. 单选题 | |
|
化学与生产生活密切相关,下列说法错误的是( )
A . 铁粉有还原性可作吸氧剂
B . 生石灰能与水反应可作干燥剂
C . 福尔马林能杀菌防腐可作食品保鲜剂
D . 明矾能水解形成胶体可作净水剂
|
|
| 8. 实验探究题 | |
|
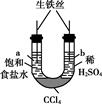
某铜合金中Cu的质量分数为80%~90%,还含有Fe等。通常用间接碘量法测定其中Cu的含量,步骤如下:
Ⅰ.称取a g样品,加入稀H2SO4和H2O2溶液使其溶解,煮沸除去过量的H2O2 , 冷却后过滤,滤液定容于250 mL容量瓶中; Ⅱ.取50.00 mL滤液于锥形瓶中,加入NH4F溶液,控制溶液pH为3~4,充分反应后,加入过量KI溶液,生成白色沉淀,溶液呈棕黄色; Ⅲ.向Ⅱ的锥形瓶中加入c mol·L−1 Na2S2O3溶液滴定,至锥形瓶中溶液为浅黄色时,加入少量淀粉溶液,继续滴至浅蓝色,再加入KSCN溶液,剧烈振荡后滴至终点; Ⅳ.平行测定三次,消耗Na2S2O3溶液的体积平均为v mL,计算铜的质量分数。 已知:ⅰ.F−与Fe3+生成稳定的FeF63−(无色)。 ⅱ.I2在水中溶解度小,易挥发。 ⅲ.I2+I− ⇌ I3−(棕黄色)。 ⅳ.I2+2Na2S2O3= 2NaI+Na2S4O6(无色)。
|
|
| 9. 综合题 | |
|
某炼锌厂利用含ZnO的烟尘脱除硫酸工艺烟气中的SO2制ZnSO4。
已知:Ⅰ.ZnSO3· Ⅱ.25℃时,溶液中S(+4价)各组分的物质的量分数随pH变化曲线如下图。 Ⅲ.O3为强氧化剂,1 mol O3被还原转移2 mol e− , 同时生成1 mol O2。
|
|
| 10. 单选题 | |
|
化学与生产、生活密切相关。下列说法错误的是( )
A . 维生素C具有还原性,应密封保存
B . 用Na2S处理工业废水中的Cu2+、Hg2+等重金属离子
C . 75%的酒精能使蛋白质变性,可用于医用消毒
D . 酸性洁厕灵与碱性“84消毒液”共用,可提高清洁效果
|
|
- 辽宁省大连市2020年高考化学二模试卷
- 2016-2017学年湖南省株洲市醴陵二中、醴陵四中两校联考高一上学期期中化学试卷
- 2015年四川省攀枝花市米易中学高考化学模拟试卷(4)
- 2016-2017学年陕西省商洛市商州区中学高二上学期期中化学试卷
- 人教版化学高一必修1第三章第三节用途广泛的金属材料同步练习
- 安徽省A10联盟2016-2017学年高三下学期理综化学开学考试试卷
- 备考2020年高考化学二轮专题 05 无机非金属及其化合物
- 上海市松江区2018-2019学年高考化学一模考试试卷
- 备考2020年高考化学二轮专题 15 无机物的转化鉴别
- 江苏省盐城市2018-2019学年高二下学期化学期末考试试卷
- 贵州省毕节市威宁县2019-2020学年高二下学期化学期末考试试卷
- 北京市朝阳区2017-2018学年高二下学期化学期末考试试卷


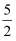 H2O微溶于水,ZnSO4易溶于水。
H2O微溶于水,ZnSO4易溶于水。




