第二节 化学计量在实验中的应用 知识点题库
回答下列问题:

-
(1) 该浓盐酸中HCl的物质的量浓度为.
-
(2) 取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 .A . 溶液中HCl的物质的量 B . 溶液的浓度 C . 溶液中Cl﹣的数目 D . 溶液的密度
-
(3) 某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.4000mol•L﹣1的稀盐酸.
可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④药匙;⑤量筒;⑥托盘天平.
请回答下列问题:
①配制稀盐酸时,还缺少的仪器有(写仪器名称);该仪器上标有以下五项中的;
A.温度 B.浓度 C.容量 D.压强 E.刻度线
②该学生需要量取mL上述浓盐酸进行配制.
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”).
a.用量筒量取浓盐酸时俯视观察凹液面.
b.量筒量取浓盐酸后有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中.
-
(4) ①假设该同学成功配制了0.400mol•L﹣1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取mL盐酸.②假设该同学用新配制的盐酸中和含0.4gNaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是.
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出.
-
(1) 在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是。
-
(2) A、B两种气体组成的混合气体8.6 g,在标准状况下体积为8.96 L。已知A与B的物质的量之比为3∶1,相对分子质量之比为14∶1,由此可推断A可能是,B可能是。
-
(3) 在标准状况下,CO和CO2的混合气体质量为36 g,体积为22.4 L,则CO所占的体积是L,质量是 g。
-
(1) 上述仪器中,在配制稀H2SO4时用不到的有(填代号)。
-
(2) 经计算,需浓H2SO4的体积为。现有:①5 mL、②10 mL、③20mL、④50 mL三种规格量筒,你选用的量筒是。
-
(3) 在配制过程中,其他操作都准确,下列操作中:错误的是,能引起浓度偏高的有(填代号)。
①将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③洗涤溶解用的烧杯与玻璃棒,并将洗涤液转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
-
(4) 所得溶液中氢离子和硫酸根离子个数比是。
-
(1) 气体的物质的量。
-
(2) 在标准状况下的体积。
-
(3) 分子数目。
由此推断出化合物M中x:y为。写出简要计算过程:。
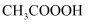 )、乙醚和氯仿等溶剂均可有效灭杀该病毒。下列有关说法正确的是( )
)、乙醚和氯仿等溶剂均可有效灭杀该病毒。下列有关说法正确的是( )
 个
D . 多种杀毒剂混合使用,消毒效果一定更好
个
D . 多种杀毒剂混合使用,消毒效果一定更好
| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 配制100mL一定物质的量浓度的NaCl溶液 | 100mL容量瓶、胶头滴管、烧杯、量筒、玻璃棒 | 蒸馏水、NaCl固体 |
| B | 制备Fe(OH)3胶体 | 烧杯、酒精灯、胶头滴管 | 蒸馏水、饱和FeCl3溶液 |
| C | 测定NaOH溶液浓度 | 烧杯、锥形瓶、胶头滴管、酸式滴定管 | 待测NaOH溶液、已知浓度的盐酸、甲基橙试剂 |
| D | 制备乙酸乙酯 | 试管、量筒、导管、酒精灯 | 冰醋酸、无水乙醇、饱和Na2CO3溶液 |

已知:①图中所列各步变化均已完全反应;②气体乙中含有2种单质气体。
-
(1) 化合物甲的化学式是,气体丁的电子式为。
-
(2) 步骤①的化学方程式为,步骤②的离子方程式为。
-
(3) 化合物甲的某种晶体在一定条件下能溶于NaOH溶液,并有刺激性气味的气体逸出。
①化合物甲与NaOH溶液反应的化学方程式为。
②若检验所得溶液显碱性,常用到的试剂是;若反应所得溶液中还存在另一种阴离子,则检验该阴离子常用的试剂是。
-
(1) 用双线桥表示该反应中电子转移的方向和数目,该反应中还原产物与氧化产物的质量之比是,0.2mol KIO3参加反应时,转移的电子为mol。
-
(2) 上面实验中用到一定物质的量浓度的稀硫酸,若配制1.0 mol/L的稀硫酸500mL,配制中需要用到的主要玻璃仪器有(填选项),需用18.0mol/L 浓硫酸mL。
a.100mL量筒 b.玻璃棒 c.100mL容量瓶 d.50mL量筒 e.胶头滴管
f.烧杯 g.500mL容量瓶
-
(3) 下面操作造成所配稀硫酸溶液浓度偏高的有(填选项)。
a.溶解后溶液没有冷却到室温就转移;b.转移时没有洗涤烧杯、玻璃棒;c.转移过程中有少量液体流出;d.向容量瓶加水定容时眼睛俯视液面;e.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线



