第二节 离子反应 知识点题库
①CO32-+2H+=CO2↑+H2O
②Ba2++2OH-+2H++SO=BaSO4↓+2H2O
③Ag++Cl-=AgCl↓
④Fe+Cu2+=Fe2++Cu
⑤Cl2+H2O=H++Cl-+HClO
| 实验操作 | 实验现象 | 实验结论 | |
| A. | 向某溶液中滴加K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 该溶液中有Fe2+,无Fe3+ |
| B. | 将溴乙烷与NaOH醇溶液加热反应产生的气体通入盛有酸性高锰酸钾的试管中 | 试管中的溶液紫色褪去 | 溴乙烷发生了消去反应,生成了乙烯气体 |
| C. | 向蔗糖与稀硫酸加热反应后的溶液中先加入过量的NaOH溶液,再加入少量新制的氢氧化铜悬浊液,加热5分钟 | 溶液中产生砖红色沉淀 | 蔗糖水解产生了葡萄糖 |
| D. | 用坩埚钳夹住一块铝箔在酒精灯上加热 | 铝箔熔化,失去光泽并滴落下来 | 金属铝的熔点较低 |
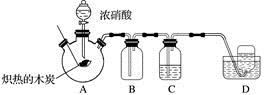
请回答下列问题:
-
(1) 检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,伸入三口烧瓶中,并塞紧瓶塞,滴加浓硝酸,可观察到三口烧瓶中气体的颜色为,产生该气体的化学方程式是。
-
(2) 装置C中盛有足量Ba(OH)2溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,该白色沉淀为(填化学式)。
-
(3) 装置B的作用是。
-
(4) 装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。
①下列对该气体的检验方法合适的是。
A.敞口观察装置D中集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶中收集的无色气体是氧气,则氧气的来源是。
 氨水溶液:Na+、K+、OH-、NO
氨水溶液:Na+、K+、OH-、NO  B .
B .  盐酸溶液:Na+、K+、SO
盐酸溶液:Na+、K+、SO 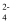 、SiO
、SiO 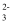 C .
C .  KMnO4溶液:NH
KMnO4溶液:NH  、Na+、NO
、Na+、NO  、I-
D .
、I-
D .  AgNO3溶液:NH
AgNO3溶液:NH  、Mg2+、Cl-、SO
、Mg2+、Cl-、SO 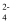
 、
、  B . 强碱性溶液:
B . 强碱性溶液:  、 Na+、Cl-、
、 Na+、Cl-、  C . 强酸性溶液: Fe2+、 K+、ClO-、
C . 强酸性溶液: Fe2+、 K+、ClO-、  D . 在碳酸钠溶液中: K+、
D . 在碳酸钠溶液中: K+、  、Cl-、
、Cl-、 
-
(1) X元素的一种核素原子核内只有1个中子,写出这种核素的符号。
-
(2) 1mol
 所含电子的数目为。
所含电子的数目为。
-
(3) 由X、Y、Z三种元素构成的常见化合物与稀硫酸反应的化学方程式为。
-
(4) W的一种氧化物为常见空气污染物。写出该氧化物与过量
 溶液反应的化学方程式为。
溶液反应的化学方程式为。
-
(5) 写出Z和R两种元素形成的化合物在水溶液中的电离方程式。
 减小
B . 将CH3COONa溶液从20℃升温至30℃,溶液中
减小
B . 将CH3COONa溶液从20℃升温至30℃,溶液中  增大
C . 向盐酸中加入氨水至中性,溶液中
增大
C . 向盐酸中加入氨水至中性,溶液中  >1
D . 向AgCl、AgBr的饱和溶液中加入少量AgNO3 , 溶液中
>1
D . 向AgCl、AgBr的饱和溶液中加入少量AgNO3 , 溶液中  不变
不变

已知:①25℃时相关物质的Ksp见下表。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
②氢氧化氧锰(MnOOH)难溶于水和碱性溶液:“沉淀池I”的条件下,Co2+不能被二氧化锰氧化。
回答下列问题:
-
(1) MnOOH中Mn的化合价为价。
-
(2) 为提高“酸浸”的效率,可以采取的措施为。(写一种)
-
(3) 向“沉淀池I”中加入MnO2 , MnO2的作用是;“滤渣2”的主要成分是(填化学式)。
-
(4) MnSO4转化为MnOOH的离子方程式为。
-
(5) 在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中Al3+完全沉淀,则理论上pH的最小值为(当溶液中某离子浓度c≦1.0×10-5mol·L-l时,可认为该离子沉淀完全)。
 B . 氨气的实验室制法:
B . 氨气的实验室制法: C . 碳酸氢钠溶液中加入氢氧化钠溶液:
C . 碳酸氢钠溶液中加入氢氧化钠溶液: D . 向澄清石灰水中通入少量
D . 向澄清石灰水中通入少量 :
:
①用石蕊试液检测该溶液时,溶液显红色。
②取2mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。
③对②中所得的混合物充分静置后,取其上层澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀。
请回答下列问题:
-
(1) 原溶液中一定存在的离子是,一定不存在的离子是。
-
(2) 在上述实验操作中,不合理的步骤是(填代号)。对该步骤改正的方法是。
① | ② | ③ | ④ | |
pH | 12 | 12 | 2 | 2 |
溶液 | 氨水 | NaOH溶液 | 醋酸溶液 | 盐酸 |
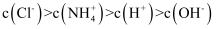 D . 若
D . 若 ④与
④与 ②混合后所得溶液的pH=3,则
②混合后所得溶液的pH=3,则
-
(1) Ⅰ.某无色透明溶液中可能大量存在
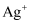 、
、 、
、 、
、 、
、 、
、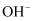 、
、 中的几种,请填写下列空白:
中的几种,请填写下列空白:不做任何实验就可以肯定原溶液中不存在的离子是。
-
(2) 取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。有关的离子方程式,取(2)中的滤液,加入过量的烧碱,出现白色沉淀。
-
(3) 综上所述,原溶液中一定存在的离子有,可能存在的离子是。
-
(4) Ⅱ.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(
 ),碘酸钾和碘化钾在酸性溶液中能发生下列反应:
),碘酸钾和碘化钾在酸性溶液中能发生下列反应: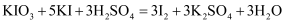 。回答下列问题:
。回答下列问题:该反应中,氧化剂是
-
(5) 当有
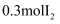 生成时,转移电子的数目为。
生成时,转移电子的数目为。
-
(6)
 为淡棕黄色气体,可由新制的
为淡棕黄色气体,可由新制的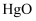 和
和 反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。则制备
反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。则制备 的化学方程式为
的化学方程式为



