第三节 硫和氮的氧化物 知识点题库
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )
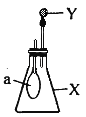
①天然水的处理可用明矶作混凝剂,其含有的铝离子水解生成的(填化学式)胶体能吸附水中的悬浮颗粒并使之沉降.
含有油类、氰化物、硫化物等的工业废水可以用(填“中和”、“氧化还原”或“沉淀”)法处理,
②生活垃圾的处理与再利用,既可以保护环境又可以节约资源.废纸、塑料、废金属等属于(填“有机垃圾”、“危险废物”或“可回收垃圾”)•生活垃圾常用的三种处理方法是堆肥、卫生填埋和
③酸雨是指pH<5.6的降水,主要是由人为排放到大气中的等酸性气体转化而成的.
在煤中加入适量的石灰石作脱硫剂,可以减少煤燃烧时产生的SO2 , 脱硫后产生的废料中含有的CaSO4可用于制造建筑材料,则石灰石脱硫时发生反应的化学方程式为.
①“PM2.5”是细小颗粒物悬浮在空气中形成胶体,严重危害人体健康
②纯碱既属于正盐又属于钠盐和碳酸盐
③相同温度下,氢氧化钠溶液的导电能力与氨水溶液强
④丁达尔效应可用于区别溶液和胶体,烟、云、雾均为胶体,能产生丁达尔效应.
⑤钢铁的吸氧腐蚀,负极发生反应:Fe﹣2e﹣═Fe2+ .
-
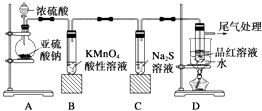
(1) 装置A中盛放亚硫酸钠的仪器名称是,其中发生反应的化学方程式为
-
(2) 实验过程中,装置B、C中发生的现象分别是、,这些现象分别说明SO2具有的性质是和.装置B中发生反应的离子方程式为;
-
(3) 装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象.
-
(4) 尾气可采用溶液吸收.
-
(5) 碳单质和浓硫酸会在加热时发生反应,写出反应化学方程式除去CO2中含有的少量SO2可选择通过溶液.
-
(6) 描述实验室稀释浓硫酸的方法.
实验步骤:
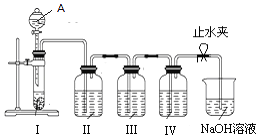
①按照图示装置连接好实验仪器,检查装置气密性.②分别在装置I、II、III、IV中分别加入少许亚硫酸钠固体、2mL稀NaOH溶液(溶液中滴有酚酞试剂)、2mL酸性KMnO4溶液、2mL Na2S稀溶液;烧杯中加入约30mL浓NaOH溶液;最后向装置A中加入30mL硫酸.③打开止水夹,再慢慢地打开分液漏斗活塞,使其中的硫酸缓缓地滴下,注意观察装置II、III、IV内溶液中的现象.
通过上述实验,回答下列试题:
-
(1) 仪器A的名称是.
-
(2) 装置II中的现象为,原因是.
-
(3) 装置III中发生反应的离子方程式为,若将装置III中的酸性KMnO4溶液换为氯水,则装置III中的现象是.
-
(4) 装置IV中的Na2S用量不同发生的化学反应方程式不同.写出Na2S足量时的化学方程式.
-
(5) 烧杯中的浓NaOH溶液的作用是.
-
(6) 在BaCl2溶液中通入SO2气体,溶液仍澄清;若将BaCl2溶液分盛两支试管.一支加硝酸,另一支加烧碱溶液,然后再通入SO2气体,结果两支试管都有白色沉淀.由此得出下列结论合理的是.
a.氯化钡有两性 b.两支试管的沉淀均是亚硫酸钡
c.SO2有还原性和酸酐的性质 d.升高pH使SO2水溶液中SO32﹣浓度增大.
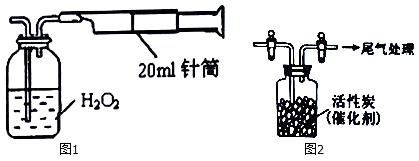
I.某实验小组同学拟用如图1所示简易装置测定空气中SO2的含量.
实验操作如下:按图连接好仪器,检查装置气密性后,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4).在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.233mg.
-
(1) 计算所测空气中SO2含量为 mg•L﹣1 .
-
(2) 已知常温下BaSO3的Ksp为5.48x10﹣7 , 饱和亚硫酸溶液中c(SO32﹣)=6.3x10﹣8mol•L﹣1 .
有同学认为以上实验不必用H2O2吸收SO2 , 直接用0.1mol•L﹣1BaCl2溶液来吸收SO2即可产生沉淀.请用以上数据分析这样做是否可行.
-
(3) 另一实验小组同学依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2 .
用如图2所示装置收集满Cl2 , 再通入SO2 , 集气瓶中立即产生无色液体,充分反应后,将液体和剩余气体分离,进行如下研究.
写出二氧化锰和浓盐酸反应制取氯气的离子方程式.
-
(4) 研究反应的产物.向所得液体中加水,出现白雾,振荡、静置得到无色溶液.经检验该溶液中的阴离子(除OH﹣外)只有SO42﹣、Cl﹣ , 证明无色液体是SO2Cl2 .
写出SO2Cl2与H2O反应的化学方程式.
-
(5) 研究反应进行的程度.用NaOH溶液吸收分离出的气体,用盐酸酸化后,再滴加BaCl2溶液.产生白色沉淀.
①该白色沉淀的成分是.
②SO2和Cl2生成SO2Cl2的反应可逆反应(填“是”或“不是”),阐述理由.
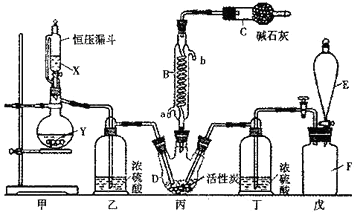
-
(1) 仪器E的名称是,由B的使用可知SO2与氯气之间的反应属于(填“放”或“吸”)热反应,B处反应管冷却水应从 (填“a”或“b”)接口通入。如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是。
-
(2) 试剂X、Y的组合最好是。
a.98%硫酸和铜 b.稀硝酸和亚硫酸钠固体 c.60%硫酸和亚硫酸钾固体
-
(3) 戊是贮气装置,则E中的试剂是;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是.
-
(4) 取1.00g蒸馏后的液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.50g,则所得馏分中二氯化砜的质量百分含量为 %(结果保留小数点后1位)。
-
(5) 二氯化砜应储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是。
-
(1) NO2会产生硝酸型酸雨,硝酸型酸雨中主要溶质的化学式为。
-
(2) 目前新出厂的汽车均加装尿素[CO(NH2)2]箱,尾气中NO、NO2及尿素以物质的量之比1:1:1加热催化生成无害气体的化学方程式为。
-
(3) 氨化法同时脱硫脱硝的原理如下(已知NH4NO2在浓度较大时会分解)
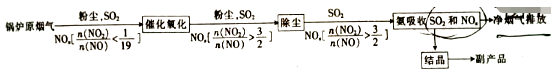
①“催化氧化”的目的是。
②最终得到副产品的主要成分为(填化学式)。
③相同条件下用氨水作吸收剂,NOx的脱除率与pH及
 的关系如图所示。
的关系如图所示。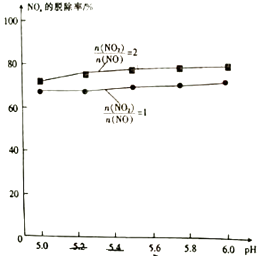
pH及其他条件相同时,
 的比值越大,NOx的拖出率也越大,其主要原因是。
的比值越大,NOx的拖出率也越大,其主要原因是。
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
-
(1) 某工业废水中含有一定量的
 和
和  ,二者存在平衡:2
,二者存在平衡:2  (黄色)+2H+
(黄色)+2H+ 
 (橙色)+2H2O
(橙色)+2H2O ①若平衡体系滴加少量浓H2SO4(不考虑温度的影响),溶液显色。
②能说明该反应达平衡状态的是。
a.
 和
和  的浓度相同 b.2v(
的浓度相同 b.2v(  )=v(
)=v(  ) c.溶液的颜色不变
) c.溶液的颜色不变 -
(2) H2O2 稀溶液易被催化分解,可使用的催化剂为(填序号)。
a.MnO2 b.FeCl3 c.Na2S2O3 d.KMnO4
-
(3) 密闭容器中发生如下反应:A(g)+3B(g)
 2C(g) ΔH<0,根据下列速率—时间图象,回答下列问题。
2C(g) ΔH<0,根据下列速率—时间图象,回答下列问题。 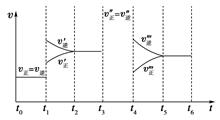
①下列时刻所改变的外界条件是:
t1;t3;t4;
②产物C的体积分数最大的时间段是;
③反应速率最大的时间段是。
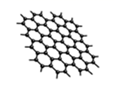
-
(1) 金刚石中碳原子的杂化方式为,每个碳原子的配位数为
-
(2) 下列有关石墨烯说法正确的是___________。A . 所有碳原子位于同一平面上 B . 石墨烯具有良好的导电性 C . 12g石墨烯所含σ 键数目为 NA 个 D . 熔点高,硬度大,不溶于有机溶剂
-
(3) 碳有很多同素异形体,C60就是其中一种。C60可用作储氢材料,已知金刚石中 C-C 键的键长为0.154nm,C60中C-C 键键长为 0.140~0.145nm,有同学据此认为 C60 的熔点高于金刚石,你认为是否正确?,阐述理由∶。
-
(4) 科学家把 C60和K 掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为。
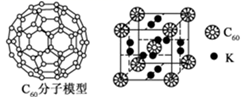
-
(5) 碳与硅为同主族元素。硅在自然界大多以硅酸盐形式存在。在硅酸盐中,SiO4四面体[如图(a)] 通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为,化学式为(Si个数可用n表示)。
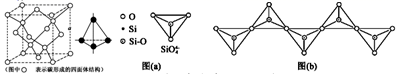
-
(6) 将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代可形成碳的一种新型三维立方晶体结构T-碳。已知T-碳密度为ρg/cm3 , 阿伏加德罗常数为NA , 则 T-碳的晶胞参数a=pm(写出表达式即可)。
-
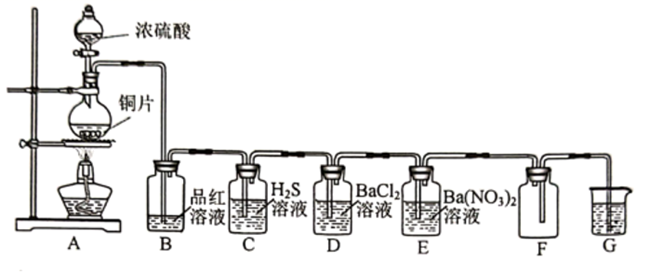
(1) A装置中用于滴加浓硫酸的仪器名称是。
-
(2) 当装置B中出现的现象时,证明生成了SO2;若装置C中观察到淡黄色沉淀,说明SO2具有性。
-
(3) 装置G中盛放的试剂为_______________(填标号)。A . NaOH溶液 B . 硫酸 C . Cu(NO3)2溶液
-
(4) 装置D中无明显现象,装置E中产生白色沉淀,猜测该沉淀可能是,理由是,对应的离子方程式为。
 B .
B .  C .
C .  D .
D . 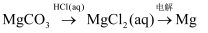
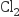 和
和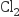 互为同位素
B .
互为同位素
B .  和
和 的相互转化是物理变化
C . 金刚石、石墨、
的相互转化是物理变化
C . 金刚石、石墨、 互为同素异形体
D .
互为同素异形体
D .  和
和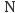 两种核素的中子数相等
两种核素的中子数相等



