测定空气中的氧气含量 知识点
药品选择:在空气中能燃烧且生成物为固体的物质
注意事项:(1)药品需过量;(2)装置不漏气
误差分析:(1)结果偏小原因:装置漏气或药品不足或读数过早;(2)结果偏大原因:伸入物质时过慢或止水夹未夹紧。
测定空气中的氧气含量 知识点题库
①空气中按体积分数计算,占78%,约占21%。
②小白鼠在装有空气的密闭容器中可存活一段时间说明空气中含有。
③夏天,盛放冰棒的杯子外壁上附有一层水珠,说明空气中含有。
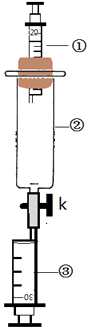
等集气瓶冷却到室温后,打开止水夹,发现水能倒流到集气瓶中,但不足1/5,试分析造成实验误差的原因(写两点)
①;
②。
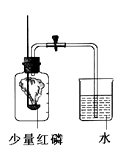
-
(1) 写出该反应的符号表达式。
-
(2) 该实验中白磷需稍过量,目的是。
-
(3) 白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是;
若实验非常成功,最终集气瓶中水的体积约为mL。
-
(4) 若将白磷换成炭粉,该实验能否获得成功?为什么?成功,原因;
-
(5) 集气瓶里预先装进的50mL水,在实验过程中起到哪些作用?______(填写序号)A . 加快集气瓶内气体冷却 B . 液封导气管末端以防气体逸出 C . 缓冲集气瓶内气压的骤然升高
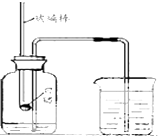
-
(1) 如图所示装置和药品进行实验,可观察到的现象是:,打开止水夹后看到 。
-
(2) 小明同学认为可用木炭代替红磷测定空气中氧气的含量,小丽同学认为不可以,其原因是。
-
(3) 小兰同学用上图所示的装置测定空气中氧气的含量,实验前止水夹应(填“关闭”或“打开”),实验后发现测得的氧气体积分数小于1/5,请你帮她分析造成这种结果的可能原因(填两点):① ;② 小明同学做此实验时,发现流向广口瓶的水多于1/5,则可能的原因是(选填序号)①红磷燃烧时,弹簧夹未夹紧 ②装置漏气 ③红磷的量太多
-
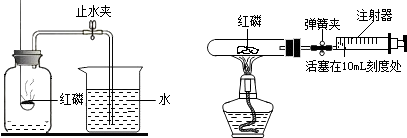
(4) 小组内同学还对该实验进行了如右图改进(已知试管容积为45mL)。实验的操作步骤如下:①点燃酒精灯.②撤去酒精灯,待试管冷却后松开弹簧夹.③将少量红磷平装入试管中,将20mL的注射器活塞置于10mL刻度处,并按上图中所示的连接方式固定好,再将弹簧夹紧橡皮管.④读取注射器活塞的数据。你认为正确的实验操作顺序是 (填序号)。注射器活塞将从10mL刻度处慢慢前移到约为mL刻度处才停止.
-
(5) 实验结论: 。
-
(6) 写出该反应的化学方程式是
-
(7) 启示:通过实验,我们还可知道氮气的物理性质和化学性质
(实验步骤)
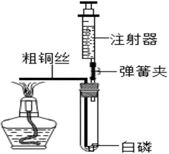
①测量试管的容积;
②检查装置气密性;
③将足量白磷置于试管底部,将注射器活塞调整到合适位置,连接好仪器;
④用弹簧夹夹紧胶皮管,加热粗铜丝,观察现象;
⑤燃烧结束后,打开弹簧夹,观察注射器活塞的移动情况。
(反思交流)
-
(1) 该装置气密性检查的方法是。
-
(2) 经测量试管容积为40mL,加热前注射器活塞至少应调到mL。
-
(3) 加热粗铜丝一段时间看到试管内的现象是。
-
(4) 试管里反应的文字表达式为。
-
(5) 该装置相对于课本实验的优点是.。
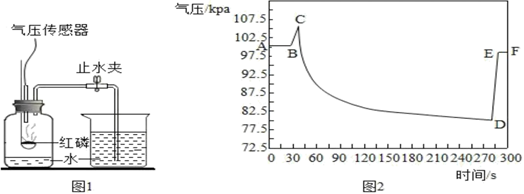
(拓展延伸)下面实验是同学们进行的拓展实验,图1为利用气压传感器按照课本实验装置测定红磷燃烧时集气瓶内气压变化的实验装置。点燃燃烧匙内的红磷后,立即伸入集气瓶中并把塞子塞紧待红磷熄灭并冷却后,打开止水夹。集气瓶内气压的变化情况如图2,则AB段气压变化不大的原因是; BC段气压增大的主要原因是;CD段气压减小的主要原因是;DE段气压增大的主要原因是。
|
实验装置 |
实验过程 |
实验现象 |
|
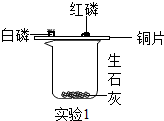
| ①取一烧杯,加入适量的生石灰,再分别取少量白磷、红磷放在烧杯上的铜片上. ②… | 一会儿白磷发生燃烧,红磷不燃烧 |
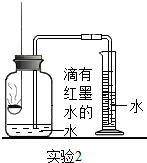
| | ③先在容积为350mL的集气瓶中装进50mL滴有红墨水的水,在燃烧匙中放足量白磷,量筒中盛入足量水. ④按图连好仪器,用激光手电照射白磷,白磷燃烧. | 集气瓶和量筒中的水均为红色,量筒内的液体体积减少约60mL |
-
(1) 实验过程②是,烧杯中发生反应的化学方程式为;
-
(2) 白磷燃烧反应的化学方程式为;
-
(3) 根据实验2的结果,计算空气中氧气的体积分数约为(写出计算式和结果);
-
(4) 在整个实验2的过程中,集气瓶内的压强变化是。
-
(5) 集气瓶中预先装入50mL水,水起的作用是。
|
| | | |
| A | B | C | D |
-
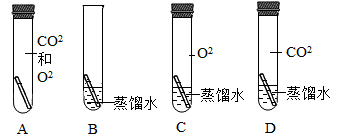
(1) 初中化学有很多实验,若按照实验目的可将实验分为:探究物质组成的实验,探究物质反应前后质量关系的实验、物质检验的实验等,我们可以将实验中D与(填“A”或“B”或“C”)归为一类,分类依据是。
-
(2) 学习了金属活动性顺序后,某同学通过查阅资料发现有下列反应:
 ,
,  ,则在铁、镍、铜三种金属中,活动性最强的金属是,请运用类比的方法写出铝丝和氯化镍溶液反应的化学方程式。
,则在铁、镍、铜三种金属中,活动性最强的金属是,请运用类比的方法写出铝丝和氯化镍溶液反应的化学方程式。
-
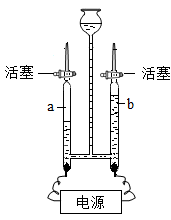
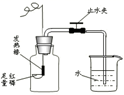
(1) 通电使红磷燃烧,燃烧的现象是 。
-
(2) 该实验能否用足量的木炭代替红磷?为什么?。
-
(3) 用通电的方法引燃红磷与用酒精灯引燃红磷相比,优点是。(写一条即可)
-
(1) 实验一:制取“富氧空气”

用高锰酸钾制取氧气
①写出反应的化学方程式:
②仪器C的名称为;
-
(2) 混制“富氧空气”

如图,用纯氮气及上述实验制取的氧气,混制一瓶氧气体积分数为40%的“富氧空气”,气体应从装置中的管(选“a”或“b”)通入,先通入氮气排出120ml水,再通入氧气排出ml水。
-
(3) 实验二:测定“富氧空气”中氧气的含量
用下图装置测定“富氧空气”中氧气的含量(集气瓶中"富氧空气"体积为100ml,底部残留少量水,燃烧匙内有足量红磷)。操作如下:

i往量筒内加入适量水,读出量筒内水的体积为V1ml;
ii用电点火装置点燃红磷,充分反应;
iii打开止水夹,待右侧量筒内液面不再变化时,排出气球中的气体,调节两边液面在同一水平面上,读出量筒内水的体积为V2ml。回答问题:
实验前,检查装置气密性的方法:;
-
(4) 操作 ii中可观察到现象:
-
(5) 本次实验测得“富氧空气”中氧气的含量为(用含V1、V2的式子表示)。
-
(6) 若读取V1时仰视,读取V2时俯视,则测得实验结果(选填“偏大”“偏小”或“无影响”)。
-
(7) 实验三:研究“富氧空气”的应用
通过重油、褐煤在氧气含量不同的空气中燃烧的实验,得到有关数据如下图:
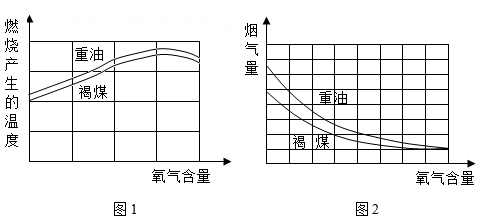
结合图1,说明空气中氧气含量与燃烧产生的温度的关系:。
-
(8) 结合图2,简述减少燃料燃烧尾气污染的措施:。
-
(1) I.李明同学想要制取较大量的氧气,请从下图中选择合适的仪器或装置组装成一套能随时控制反应速率的制取装置,需要用到的是(填标号),该反应的化学方程式。

-
(2) 实验后,李明准备将发生装置的固体进行回收而采用了过滤操作,其中玻璃仪器除了要选上图仪器(填标号),还需补充的玻璃仪器是。
-
(3) II.
图1
图2

图3
图4
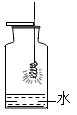
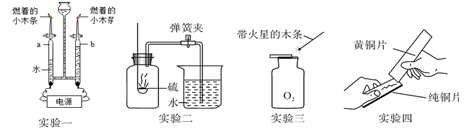
丽丽同学用图1装置探究燃烧的条件。(白磷的着火点为40℃,红磷的着火点为240℃)通过观察到的现象,说明燃烧需要的条件是温度达到可燃物的着火点、。
-
(4) 小青同学通过图2实验测定空气中氧气体积分数时,测得的结果偏小,可能的原因是(从以下选项中选填序号)
a 集气瓶中事先放了水 b 弹簧夹未夹紧橡皮管 c 没有冷却到室温就打开弹簧夹
-
(5) 王强同学在做图3铁丝燃烧实验时,将铁丝绕成螺旋状的目的是。
-
(6) 小张同学查阅资料得知铜锈蚀后生成铜锈,其主要成分为Cu2(OH)2CO3 , 小张结合图4实验的现象,可判断出铜生锈需要铜与同时接触。若要探究“铜生锈是否需要CO2?”,只需完成(填标号)实验即可达到实验目的。

-
(1) 加热铜丝,一段时间后瓶内白磷燃烧,这种点燃方式的优点是(写一点)。
-
(2) 图2中C点瓶内气压升高的原因是,CD段瓶内气压逐渐减小的原因是,导致DE段气压突然升高的实验操作是。
-
(3) 实验前在集气瓶中预先放入了20mL的水,其目的是,若集气瓶的容积为200mL,则理论上倒流入集气瓶中的水的体积约为mL。
-
(4) 实验后,铜丝及铜质燃烧匙均有表面变黑的现象,可能的原因是。

-
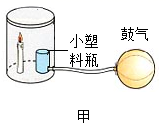
(1) 图甲所示为粉尘爆炸的实验装置。实验中吹散面粉的目的是。蜡烛的作用是,最终蜡烛熄灭的原因是。面粉发生的这个变化是(填“物理变化”或“化学变化”)。
-
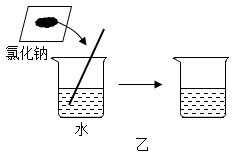
(2) 图乙是氯化钠溶解的实验。实验中用玻璃棒不断搅拌的目的是。氯化钠“消失”在水中,是因为氯化钠在溶液中以(填微粒符号)的形式存在。
在室温条件下,小明:①向100g水中加入5g氯化钠完全溶解;②在100g水中加入10g氯化钾也完全溶解。他得到的结论:氯化钾比氯化钠更易溶于水。他实验中正确的做法有(写一条,下同),不正确之处是,不正确导致了实验结论的不可信。
-
(3) 如图丙,装置中暖宝宝贴主要成分为铁粉,玻璃瓶容积为220mL,实验结束后集气瓶中水的总体积为58mL,实验中水体积变化忽略不计。集气瓶中水的作用是;反应后量筒中水进入集气瓶的原因是,使瓶内气压减小,在大气压作用下水沿导管进入玻璃瓶。实验测得空气中氧气的体积分数为。
-
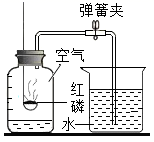
(1) 写出红磷燃烧的化学方程式。。
-
(2) 简述集气瓶内水面上升的原理。。
-
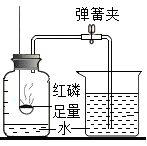
(1) 如果红磷过量所测定的氧气含量(填无影响或偏大或偏小)。
-
(2) 写出红磷燃烧的化学方程式。
-
(3) 打开弹簧夹后,烧杯中的水进入集气瓶中的原因是。
(提出问题)空气中某些气体含量的测定。
(査阅资料)通常条件下,白磷与澄清石灰水不反应;白磷燃烧和红磷燃烧相似,且更易燃烧;澄清石灰水可以吸收二氧化碳。(实验操作如图1)

-
(1) 先检查装置的,装入试剂,在医用输液袋中装入VmL空气,连接装置。
-
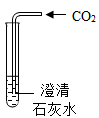
(2) 打开弹簧夹,缓慢将袋中的气体全部排除。读出量筒中液体体积为V1mL,锥形瓶中澄清石灰水的作用是。
-
(3) 关闭弹簧夹K1、K2 , 再向烧杯中加入沸水,以促使白磷迅速燃烧。待瓶中气体,再打开K2 , 读出量筒中液体体积为V2mL。测量值V1-V2是的体积(填物质名称)。
-
(4) 二氧化碳气体的测量值是(用字母表示)。