氢气的化学性质与燃烧实验 知识点
氢气燃烧产生淡蓝色火焰,火焰上方罩干而冷烧杯,烧杯内壁会有水雾
结论:2H2+O22H2O
氢气的化学性质与燃烧实验 知识点题库
A | 食品保鲜的办法 | B | 实例与原理 |
真空包装﹣﹣冷藏保鲜 充入氧气﹣﹣防止氧化 | 铁锅用完洗净干燥﹣﹣防止生锈 扑灭森林火灾时设置隔离带﹣﹣隔离可燃物 | ||
C | 日常物质的鉴别 | D | 化学中常见的“三” |
硬水和软水﹣﹣用肥皂水 酱油和醋﹣﹣闻气味 | 三种可燃性气体﹣﹣H2、CO、N2 三种可加热仪器﹣﹣试管、烧杯、量筒 |
-
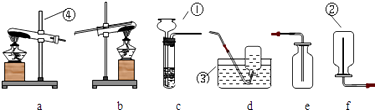
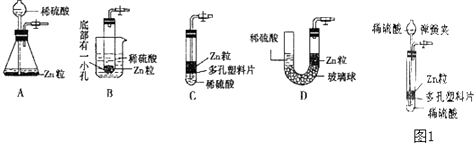
(1) 写出标号仪器的名称
①②③④
-
(2) 若要制取并收集氧气,则需和配套,若要制取并收集氢气,则需和配套.
-
(3) a的试管口略向下倾斜,是为了防止受热后的药品湿存的水分流回试管底使试管,c中的仪器①应伸至液面以下,可以防止产生的气体.e、f中的导管均应接近仪器②底部,是为了将瓶中的空气.
-
(4) 实验室要用大理石与稀盐酸在常温下反应制取二氧化碳气体,可采用图装置制取,又知CO2能溶于水,密度比空气大,所以,可采用图中的收集CO2 .
-
(5) 制取氢气并用氢气还原氧化铜,可用装置,在这个实验中有以下操作,正确的顺序是(填序号)
①向氢气发生装置里加药品;②检查装置的气密性;③给试管中的氧化铜加热;④停止加热;⑤向装有氧化铜的试管里通入氢气;⑥停止通入氢气;⑦检验氢气纯度.
-
(1) “化学使天更蓝,水更清.”汽车尾气处理装置能使某些有毒气体转化为无毒气体:2NO+2CO→N2+2CO2 . 该反应涉及的物质中,在空气中含量最高,是光合作用的原料,能与血红蛋白结合的是.竹子可加工成具有吸附作用的物质,其作用与实验室中常用的(填物质名称)相似.
-
(2) “化学为人类提供动力.”氢能属于绿色能源,氢气燃烧的化学方程式是.可燃冰是一种新型能源,在我国南海储量很高.其主要成分为甲烷(CH4),甲烷属于(填“无机物”或“有机物”).它燃烧的化学方程式为
 E
E  F
F  CuO
B . Fe2(SO4)
CuO
B . Fe2(SO4)  滤液X
滤液X  沉淀Y
沉淀Y  滤液沉淀Fe2(SO4)3
C . CuO
滤液沉淀Fe2(SO4)3
C . CuO 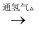 R
R  滤液J
滤液J 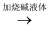 Cu(OH)2
D . BaCO3
Cu(OH)2
D . BaCO3 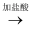 M
M  滤液Q
滤液Q 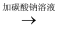 BaCO3
BaCO3
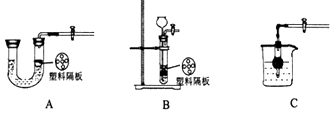
如图是实验室制备氢气的装置图.该装置的特点是:打开弹簧夹,锌粒和硫酸接触,发生反应.关闭弹簧夹后,硫酸被反应产生的氢气压回长颈漏斗,与锌粒分离,停止反应.用该装置制备氢气,可取得节约药品和取用方便的效果.
-
(1) 下面A,B,C,D 4套装置中,哪些可以产生与下图装置相同的效果?(填写编号).
-
(2) 我们在连接玻璃管和胶皮管时,若遇到玻璃管不容易插入胶皮管内的情况,应如何操作
-
(3) 若在实验室用锌粒和稀硫酸反应制取的氢气,经过净化、干燥后,用来还原氧化铜来测定铜的相对原子质量,发现实验所用的氢气质量远远超过理论值,原因是
-
(4) 现有铁和稀硫酸两种足量的原料,为了还原氧化铜中的铜,小敏的实验方案是:先制取氢气,再用氢气还原氧化铜.小红的方案是:酸与氧化铜反应,再用金属还原硫酸铜.你认为哪种方案更好,说明理由.
查阅资料知:(1)碱石灰可以吸收水蒸气、二氧化碳等气体.(2)氯化氢极易溶于水
实验步骤:①连接好装置 ② ③装入药品 ④打开分液漏斗活塞向锥形瓶中滴加入稀盐酸 ⑤一段时间点燃酒精灯 ⑥D中黑色固体完全变成红色,停止加热,待D中玻璃管冷却至室温,关闭分液漏斗活塞 ⑦数据处理

请回答下列问题:
-
(1) 实验步骤②是,如下图,保持装置内温度不变,将导管的末端伸入装有水的烧杯中,若效果良好,烧杯内导管处的现象(画圈部分)是.
选项
A
B
C
D

现象放大图




-
(2) 若使制取氢气是装置随开随用,随关随停,下列装置可选用的是.
-
(3) B装置中水的作用,C装置的作用
-
(4) 已知:CuO样品质量为m1克,E中增重为m2克,D中反应后固体质量为m3克,实际参加反应氢气的质量为m4克,试用m1 , m2列出铜的相对原子质量的表达式,若无F装置,则对测定结果的影响(填“偏大”、“偏小”、“无影响”).
-
(5) 请你评价实验有什么不妥之处,并说明原因.
-
(6) 利用A装置,加入其他药品,还可以制取的气体是(填一种).
-
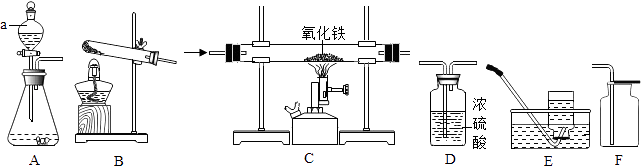
(1) Ⅰ、氯酸钾固体和二氧化锰混合加热,能较快的产生氧气.小刚同学欲在实验室中以此方法制备并收集干燥的氧气.
①所选装置的连接顺序为(填写仪器序号字母).
②用氯酸钾制备氧气的化学方程式为.
-
(2) Ⅱ、小强同学欲用锌和稀硫酸反应制取氢气,然后利用氢气测定某氧化铁样品中含Fe2O3的质量分数(假设杂质不发生反应).选择制取氢气的发生装置是,接下来连接装置的顺序为:D1→C→D2→D3 . (已知:Fe2O3+3H2
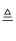 2Fe+3H2O;其中D1、D2、D3为三个盛浓硫酸的洗气瓶)
2Fe+3H2O;其中D1、D2、D3为三个盛浓硫酸的洗气瓶) ①写出仪器a的名称.在装药品之前,检查装置A气密性的具体操作是.
②小强欲通过测量反应前后D2浓硫酸洗气瓶的质量变化,测算氧化铁样品中含有Fe2O3的质量分数.实验中,在其他操作正常的条件下,若装置中不连接D1 , 则测算结果将(填写“偏小”、“偏大”或“不受影响”).
-
(1) 为了探究金属活动性,将锌和铜分别放入稀硫酸中,铜不反应而锌的表面有气泡产生,写出锌和稀硫酸反应的化学方程式:。老师告诉学生,铜和浓硫酸在加热的条件下也能反应且产生气体。
-
(2) 【提出问题】铜与浓硫酸反应的生成物是什么?其中气体是什么?
【猜想假设】同学们对产生的气体作出了猜想。
猜想一:氢气;
猜想二:二氧化硫;
猜想三:氢气和二氧化硫的混合物。
【查阅资料】
a.二氧化硫可以使品红溶液褪色,也能和碱性溶液反应
b.H2+CuO
 Cu+H2O
Cu+H2O【实验探究】师生设计了如下装置进行实验(部分仪器省略),请完成下列表格。
主要实验步骤
主要现象
解释或结论
①加热装置A一段时间
装置B中的现象是
有二氧化硫生成
②点燃装置D处酒精灯
装置D玻璃管中无明显现象
猜想正确
③停止加热,将铜丝上提,向装置A中玻璃管鼓入空气
/
/
④冷却,将A中液体用水稀释
A中液体变为色
有硫酸铜生成
-
(3) 【表达交流】
①在步骤③中,鼓入空气的目的是。
②请完成铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)
 CuSO4+SO2↑+
CuSO4+SO2↑+ -
(4) 【反思拓展】
①若将装置A中铜丝换成锌片,随着反应的进行,硫酸的浓度逐渐变小,装置D玻璃管中看到的现象是。
②下列各组药品能够证明锌的活动性比铜强的是(填序号)。
①锌、铜、稀盐酸②锌、硫酸铜溶液③锌、铜、氯化镁溶液
-
(1) 具有可燃性的气体;
-
(2) 属于空气污染物的气体;
-
(3) 空气中含量最大的气体;
-
(4) 植物光合作用吸收的气体;
-
(1) “遂古之初,谁传道之?上下未形,何由考之?”屈原的《天问》体现了中华民族对真理追求的坚韧与执着。2021年2月10日19时52分,中国首次火星探测任务“天问一号”探测器成功进入环火轨道,成为中国第一颗人造火星卫星。试回答下列问题:

①“天问一号”由长征五号遥四运载火箭发射升空,长征五号火箭采用液氢、液氧作推进剂。试写出氢气与氧气发生反应的化学方程式:。
②“天问一号”计划在2021年5月至6月择机着陆火星,释放火星车。火星车主要采用太阳能电池板发电,太阳能电池的作用是将能转化为电能。
③“天问一号”采用了我国自主研制的高性能碳化硅增强铝基复合材料。工业上制取碳化硅的化学反应方程式为:SiO2+3C高温SiC + 2X ↑,则X的化学式为。
④“天问一号”使用工程塑料、玻璃钢等作为隔热材料,用二硫化钼(MoS2)固体润滑剂等作为运动部件的润滑材料。已知MoS2中硫元素的化合价为-2价,则其中钼元素(Mo)的化合价为。
-
(2) 1926年,我国化学家侯德榜在氨碱法的基础上,创立了侯氏制碱法。“制碱”生产过程涉及到Na2CO3、NH4Cl等物质,Na2CO3和NH4Cl的溶解度曲线如图所示。试回答下列问题:

①t2℃时,Na2CO3的溶解度为g。
②t1℃时,Na2CO3饱和溶液的溶质质量分数NH4Cl饱和溶液的溶质质量分数(填“大于”“小于”“等于”之一)。
③将t1℃时NH4Cl的饱和溶液升温到t2℃,溶液中溶质的质量分数会(填“变大”“变小”“不变”之一)。
④t1℃时,向50g水中加入12g Na2CO3充分溶解,所得溶液的质量是g。
-
(1) 氢燃料电池使用过程中是将化学能转化成能。氢燃料电池公交车的投入使用能改善大连的空气质量,因为。
-
(2) 氢气可以通过电解水的方法制得,该反应化学方程式为,属于(填“化合”或“分解”)反应。
-
(3) 以锂电池为动力的新能源汽车,电池正极材料中含有LiCoO2 , 锂元素(Li)的化合价为+1价,则钴元素(Co)的化合价为价。
-
(1) 按要求从碳酸钠、甲烷、生石灰、氢氧化钠、氢氧化铁、二氧化硫中选取合适的物质,将其化学式填写在下列横线上。
①可做食品干燥剂的是。
②造成酸雨的气体。
③最简单的有机物。
④一种难溶性的碱。
⑤海水制碱中的“碱”。
-
(2) 人与自然和谐共生,关乎人类前途命运。“一起向未来”作为本届冬奥会的主题口号,表达了对人类美好明天的憧憬。试回答:
①本届奥运会自申办以来就处处践行着“绿色”—实现了奥运史上首次所有场馆全部使用清洁能源供电:采用二氧化碳制冰技术,实现了场馆热能再利用:交通服务用车最大限度使用清洁能源。氢气燃烧的化学方程式为;氢气作为能源与煤、石油相比,优点是。
②国家速滑馆又称“冰丝带”,是北京冬奥会唯一新建冰上竞赛场馆。“冰丝带”是由3360块玻璃共同拼成的。玻璃的主要成分之一是Na2SiO3。Na2SiO3中钠、氧元素的质量比为(填最简整数比):Na2SiO3中元素质量分数最小的是(填元素名称):Na2SiO3中硅元素化合价为。

-
(1) 火炬主体使用碳纤维复合材料,内嵌耐高压铝合金氢气瓶,氢气瓶属于(填“金属”或“复合”)材料;当打开减压阀时,压强从420个大气压降为1个标准大气压,氢气平稳逸出,此过程氢分子。
A.体积变大 B.间隔变大 C.质量变大 D.结构改变
-
(2) 氢气燃烧时火焰呈色,白天很难看清楚,在燃烧格栅处涂上钠盐而火焰呈现金黄色;氢气作为火炬燃料零污染的原因是。
-
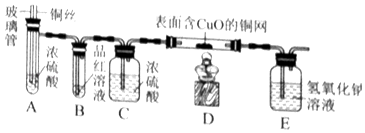
(3) 利用绿色能源生产且没有生成
 的氢气称为“绿氢”,用电电解水生产“绿氢”时,在水中加入NaOH的目的是,生成的两种气体的质量与时间的关系如图所示,其中表示氢气的是(填“a”或“b”)。
的氢气称为“绿氢”,用电电解水生产“绿氢”时,在水中加入NaOH的目的是,生成的两种气体的质量与时间的关系如图所示,其中表示氢气的是(填“a”或“b”)。 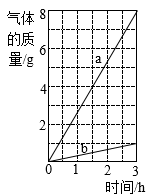

-
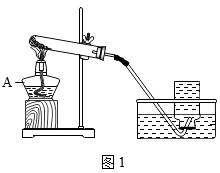
(1) 图1中仪器A的名称是,反应的化学方程式是。
-
(2) 模拟氢氧焰实验:按图2所示装置进行实验。
①关闭K,通入氢气,为保证安全,点燃氢气之前应先。点燃氢气后,可观察到(颜色)火焰,将铁丝网放在火焰上灼烧,铁丝网只发红,不熔断。
②打开K,通入氧气,火焰更明亮,铁丝熔断,由此得出的结论是。



