海洋中的资源 知识点
海洋中的资源 知识点题库
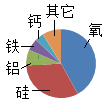
| 离 子 | Cl﹣ | X | SO42﹣ | Mg2+ | Ca2+ | K+ |
| g/1000g海水 | 19.10 | 10.62 | 2.66 | 1.28 | 0.40 | 0.38 |
(1)经分析,上表中常见阳离子X的离子符号是 .
(2)海水中镁元素主要以MgCl2和(填化学式)两种形式存在.
(3)取这种海水500g,其中所含Ca2+的质量相当于g贝壳(假定其中成分全部为CaCO3)中所含钙的质量.
 人体中
B .
人体中
B .  海水中
C .
海水中
C .  地壳中
D .
地壳中
D .  丙氨酸(C3H7O2N)中
丙氨酸(C3H7O2N)中
-
(1) 海水中资源丰富,含量最多的金属阳离子是(填符号),含量最多的分子是(填符号)。
-
(2) 下图所示是对海水的综合利用。
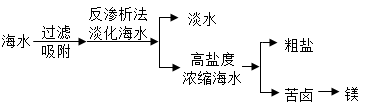
①反渗透法淡化海水是利用海水中各成分的不同分离出淡水。
②从高盐度浓缩海水中分离得到粗盐的过程是(填“物理变化”或“化学变化”)。
③用苦卤制取金属镁的流程图如下:

上述转化过程中,所发生的反应属于复分解反应类型的步骤是(填序号),步骤II的化学方程式为。利用苦卤提取氧化镁比“直接从海水中提取氧化镁”的优势是。
![]()
-
(1) 流程图涉及的物质中,属于单质的是。
-
(2) HCl能与Mg(OH)2发生了复分解反应,该反应的化学方程式为。
-
(1) 84消毒液消毒的原理就是破坏病毒结构,使其蛋白质变性,该消毒过程是(物理或化学)变化。
-
(2) 84消毒液是含氯消毒剂,这里的“氯”指的是元素,其有效成分NaClO(次氯酸钠)中氯元素的化合价是。
-
(3) 查阅资料可知,生产84消毒液的过程要用到烧碱,而工业上采用电解NaCl饱和溶液的方法来制取烧碱,同时生成氯气(Cl2)和密度最小的气体。某同学设计的工业制备氢氧化钠及84消毒液的流程如下图。
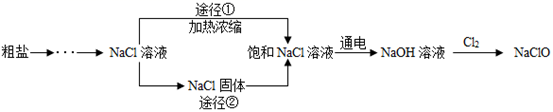
①晾晒海水得到粗盐的原理是。
②写出电解NaCl饱和溶液制取烧碱的化学方程式。
③84消毒液工业制法是利用Cl2与NaOH反应生成NaCl、NaClO和水。反应的化学方程式为
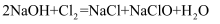 ,结合流程图中发生的反应,该过程中可以循环利用的物质是(填化学式)。
,结合流程图中发生的反应,该过程中可以循环利用的物质是(填化学式)。
请回答下列问题:
-
(1) 如图中操作b中玻璃棒的作用是。在加热蒸发过程中,当蒸发皿中时,停止加热。粗盐中除去泥沙后的澄清滤液中还含有MgCl2、CaCl2 , 要想知道该滤液是硬水还是软水,可加入进行检验。
-
(2) 如图中加入Na2CO3溶液除去的离子是(填离子符号),加入NaOH溶液发生反应的化学方程式为;加入足量稀盐酸的目的是。如果称量I中称得粗盐的质量为3g,称量Ⅱ中称得精盐的质量为3.1g,则下列分析正确的是(填字母)
A 粗盐没有完全溶解 B 除杂过程中有NaCl生成
C 蒸发时水分没有蒸干 D 称量精盐时药品和砝码的位置放反了,且使用了游码
-
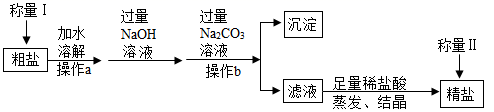
(3) 小明用所得精盐配制一定溶质质量分数的氯化钠溶液的过程如图所示:
①操作A中的不正确是。
②配制10g质量分数为15%的氯化钠溶液,所需氯化钠的质量为g。
③对配制的溶液进行检测时发现溶质质量分数偏小,其原因可能有(填字母)。
A 称量氯化钠时只在药品端垫纸片 B 量取水的体积时,仰视读数
C烧杯事先用水润洗过,内壁有水残留 D装瓶时,有少量溶液洒出
④把10g质量分数为15%的氯化钠溶液稀释成质量分数为5%的氯化钠溶液,需要水的质量是g,该实验的操作步骤为:计算、、混匀等。
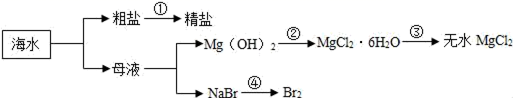
下列有关说法正确的是( )
-
(1) 下列方法中能淡化海水的是____(填字母)。A . 过滤法 B . 分解法 C . 多级闪急蒸馏法 D . 膜法
-
(2) 从海水中制备纯碱和金属镁的流程如图所示:
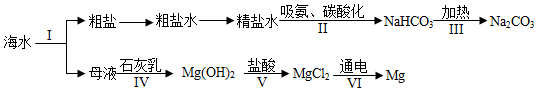
①流程Ⅰ海水晒盐得到粗盐的方法为结晶。
②写出流程Ⅲ反应的化学方程式。
③提取氯化镁历经Ⅳ、Ⅴ两步转换的目的是。流程Ⅵ实现的能量转化方式为。
-
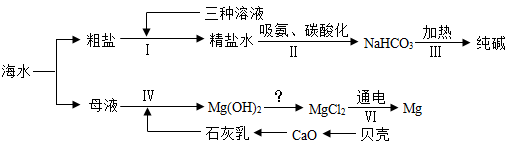
(1) 提纯物质常用转化的方法,就是将杂质转化为沉淀或气体而除去。粗盐中含有MgCl2、Na2SO4、CaCl2等可溶性杂质,通过步骤I,再利用过滤操作进行除杂提纯。
①步骤I加入下列三种溶液正确的先后顺序为。(填字母序号)
A.稍过量的Na2CO3溶液
B.稍过量的BaCl2溶液
C.稍过量的NaOH溶液
②理论上用过量的溶液(填化学式)代替NaOH和BaCl2两种溶液,也可以达到相同的实验目的。
-
(2) 步骤Ⅱ中发生反应的化学方程式为。
-
(3) 上述流程图中未涉及到的基本反应类型是。
-
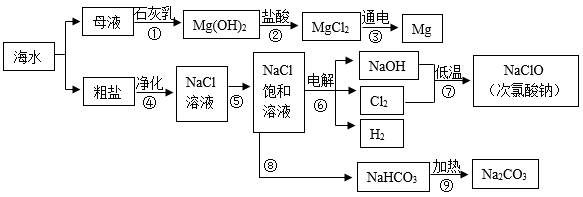
(1) 海水制镁,步骤①②③是利用母液制镁的流程,该流程中发生中和反应的化学方程式是。步骤①中制取氢氧化镁选择向母液中加入石灰乳,而不是向海水中直接加入石灰乳,原因是。
-
(2) 海水晒盐。通常采用(填“降温”或“蒸发”)结晶的方法使海水中的氯化钠析出。通过步骤④除去粗盐溶液中含有的MgCl2、Na2SO4、CaCl2等可溶性杂质,需要依次加入过量的BaCl2溶液、过量的Na2CO3溶液、过量的NaOH溶液,然后过滤,在滤液中加入适量的稀盐酸。其中加入过量的Na2CO3溶液的目的是。
-
(3) 海水制碱。步骤⑧⑨是氨碱法制纯碱的流程,步骤⑧中需要向NaCl饱和溶液中先后加入的两种物质是(写化学式)。步骤⑨中发生反应的化学方程式是。
-
(4) 步骤⑦用烧碱低温制取次氯酸钠的反应原理为:
 , 则X的化学式是。
, 则X的化学式是。



