实验装置的拆卸 知识点题库

-
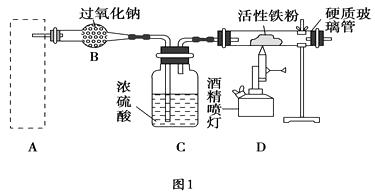
(1) 图2中仪器a的名称是。
-
(2) 根据题目要求,在图2中最好选择(填序号)作为A装置。
-
(3) 对图2中装置②进行气密性检查的方法是。
-
(4) 在B装置中发生的主要反应的化学方程式是。
-
(5) 反应一段时间后,若将硬质玻璃管中的固体粉末用盐酸溶解,取少许溶液于试管中,加入淀粉碘化钾溶液,没有蓝色出现,推测固体粉末中除Fe3O4外,一定有(填名称)。
-
(6) 写出Fe3O4溶于足量稀硫酸的离子方程式,要检验所得溶液中的Fe3+ , 常用试剂是(填名称)。
①连接好装置,检验气密性,在仪器内装入药品。
②先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
③分离C中所得的混合物,得到NaHCO3固体。
④向滤液中加入适量的NaCl固体粉末,有NH4Cl晶体析出。
-
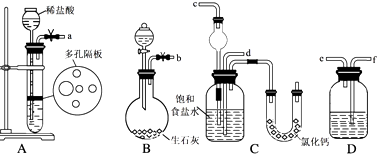
(1) 下图所示装置的连接顺序是:a接 , 接;b接(填接口编号)。
-
(2) A中反应的离子方程式为;B中常选用的液体反应物为;D中应选用的液体为。
-
(3) 步骤②让装置先发生反应。
-
(4) C中用球形干燥管而不用直导管,其作用是;装有无水CaCl2的U形管的作用是。
-
(5) 步骤③分离出NaHCO3固体的操作是。
-
(6) 步骤④中所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的 实验,不使用其他任何试剂,证明所得晶体大部分是NH4Cl。简要写出操作和现象。

-
(1) I.碳酸亚铁的制备(装置如下图所示)
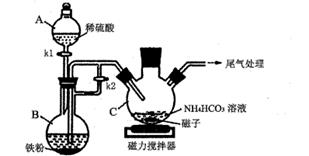
仪器B的名称是;实验操作如下:打开kl、k2 , 加入适量稀硫酸,关闭kl , 使反应进行一段时间,其目的是。
-
(2) 接下来要使仪器C中的制备反应发生,需要进行的操作是,其反应的离子方程式为。
-
(3) 仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是。
-
(4) Ⅱ.乳酸亚铁的制各及铁元素含量测定
向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
-
(5) 两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是 。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24. 80 mL,则样品纯度为%(保留1位小数)。
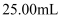 待测液时,若移液管内残留少量液体,必须用洗耳球将其吹出,否则使测量结果偏低
B . 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
C . 滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面变化
D . 吸滤完毕停止吸滤时,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关闭水龙头
待测液时,若移液管内残留少量液体,必须用洗耳球将其吹出,否则使测量结果偏低
B . 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
C . 滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面变化
D . 吸滤完毕停止吸滤时,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关闭水龙头

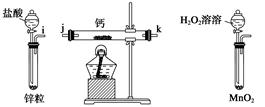
请回答下列问题:
-
(1) 请选择必要的装置,按气流方向连接顺序为(填仪器接口的字母编号)。
-
(2) 根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;_______(请按正确的顺序填入下列步骤的标号)。A . 加热反应一段时间 B . 收集气体并检验其纯度 C . 关闭分液漏斗活塞 D . 停止加热,充分冷却
-
(3) 实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色。该同学据此判断,上述实验确有CaH2生成。
①写出CaH2与水反应的化学方程式;
②该同学的判断不准确,原因是。
-
(4) 登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是。
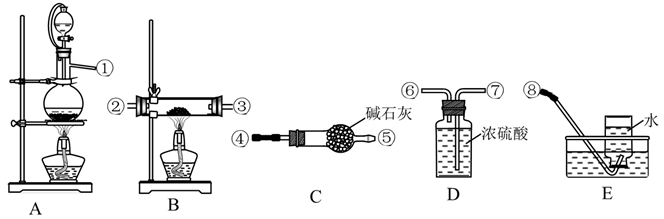
-
(1) Ⅰ、制备氮化锂:实验室用NH4Cl溶液和NaNO2溶液共热制备N2。选择下图中的装置制备氮化锂(装置可重复使用):
装置的接口连接顺序为(从左至右,填数字序号)。
-
(2) 实验室将锂保存在(填“煤油”“石蜡油”或“水”)中。
-
(3) 制备N2的化学方程式为。
-
(4) Ⅱ、测定Li3N产品纯度:取agLi3N产品按如下图所示装置实验。
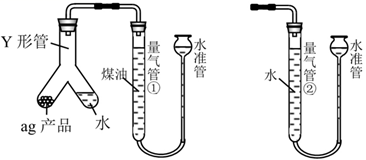
连接好装置后,检查装置气密性的操作是。装好药品,启动反应的操作是。
-
(5) 反应完毕并冷却之后,将气体全部排入量气管①中,量气管①的读数为V1mL(已换算成标准状况,下同),将量气管①中气体缓慢导入量气管②,读数为V2mL。该样品的纯度为(用含a、V1、V2的代数式表示,不必化简)。若在量气管②中V2读数时,水准管液面高于左侧液面,测得产品纯度将(填“偏高”“偏低”或“无影响”)。
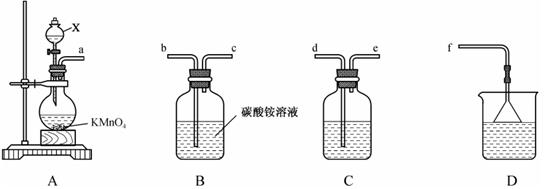
回答下列问题:
-
(1) 装置A中仪器X的名称是,盛放的试剂是,装置A中发生反应的离子方程式为。
-
(2) 整个装置的导管连接顺序为a→→→→→ 。
-
(3) 装置B中发生反应的化学方程式为。
-
(4) 装置C的作用为;装置D的作用为。
-
(5) 三氯化氮浓度的测定:准确量取20 mL装置B中反应后的溶液,置于100 mL容量瓶中,用水稀释至刻度,摇匀,吸取25.0 mL于烧杯中,加入足量V1 mL c1 mol·L-1亚硫酸钠溶液,充分反应后,向烧杯中加入足量V2 mLc2 mol·L-1 盐酸酸化的氯化钡溶液,得沉淀mg。
已知:i.Na2SO3+NCl3 +
 =Na2SO4+ HCl+NH4Cl;
=Na2SO4+ HCl+NH4Cl;ⅱ.BaCl2+Na2SO4=BaSO4↓十2HCl。
①请完成反应i的化学方程式(横线填数字,方框中填化学式):
ⅰ Na2SO3+NCl3+
 =Na2SO4+ HCl+NH4Cl
=Na2SO4+ HCl+NH4Cl②装置B反应后的溶液中三氯化氮的浓度为mol·L-1。



