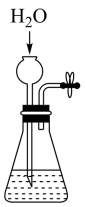
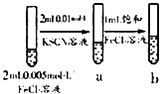气体发生装置的气密性检查 知识点题库
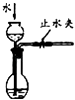
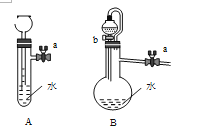
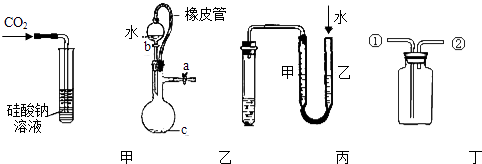
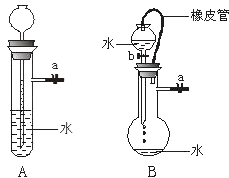
装置如图:关闭装置A中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示;关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶.则关于A、B两装置是否漏气的有关说法正确的是( )
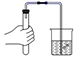
用推拉注射器活塞的方法可以检查如图所示装置的气密性.当缓慢向右拉动活塞时,如果装置气密性良好,则能观察到( )

实验 | 实验现象 | 结论 |
A |
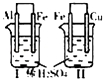
Ⅰ烧杯中铁表面有气泡Ⅱ烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
B |
试管中收集到无色气体 | 铜与浓硝酸的反应产物是NO |
C |
试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D |
长颈漏斗内液面高于烧瓶内液面且保持不变 | 装置气密性良好 |
-
(1) 关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示.试判断:A装置是否漏气?(填“漏气”、“不漏气”或“无法确定”),判断理由:.
-
(2) 关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶.试判断:B装置是否漏气?(填“漏气”、“不漏气”或“无法确定”),判断理由:.
-
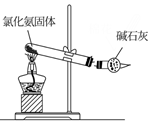
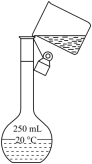
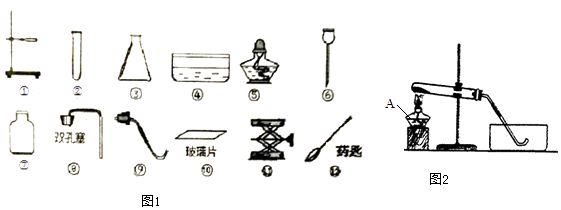
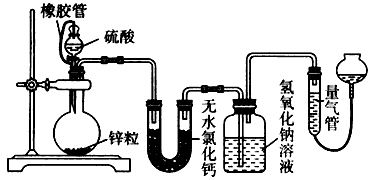
(1) 写出利用上述仪器和药品,用化学方程式表示制取该气体的化学反应原理,在制取该气体的整个实验过程中需要用到的仪器有(填仪器序号);
-
(2) 如果如图2所示用氯酸钾制氧气,请同学们将图补充完整;
-
(3) 图中用此方法收集气体时.证明该气体已经收集满的现象是;
-
(4) 实验结束后要先后.

已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2;高于60℃时NaClO2分解成NaClO3和NaCl。
-
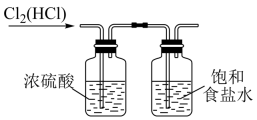
(1) 检查A装置气密性的方法是。该装置中产生ClO2的化学方程式为。
-
(2) 实验过程中需要持续通入空气,目的是。
-
(3) NaClO2在碱性溶液中才能稳定存在,下列可用于检测三颈瓶中溶液酸碱性的是(填代号)。
a.石蕊
b.酚酞
c.pH试纸
d.pH计
-
(4) B装置中发生反应的离子方程式为;使用冰水浴的原因是;反应结束后,从溶液中得到NaClO2固体的实验操作是。
-
(5) NaClO2是一种高效水处理剂,在一定条件下可以将CN-氧化成两种无毒无害的气体。现用NaClO2处理10m3含CN-a mg·L-1的工业污水,理论上至少需要NaClO2的质量是g。
 收集NO
B .
收集NO
B . 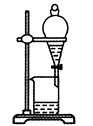 分离甘油和水
C .
分离甘油和水
C . 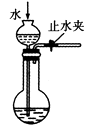 检查装置气密性
D .
检查装置气密性
D . 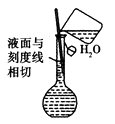 配置溶液
配置溶液
 B .
B . 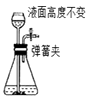 C .
C . 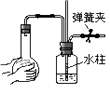 D .
D . 
-
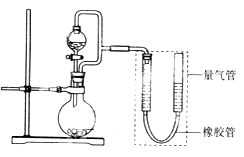
(1) 该小组设计了如上图所示的实验装置,检查该装置气密性的操作是。
-
(2) 若1.30 g锌粒完全溶解,氢氧化钠洗气瓶增重0.64 g(烧瓶中残留气体忽略不计,下同),则圆底烧瓶中发生反应的化学方程式为。
-
(3) 是否使用橡胶管,对实验结果(填“有”或“无”)影响。
-
(1) (实验一)探究影响化学反应速率的因素。
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2。
序号
V(H2SO4)/mL
c(H2SO4)/mol·L-1
t/s
I
40
1
t1
II
40
3
t2
序号
V(H2SO4)/mL
c(H2SO4)/mol·L-1
t/s
I
40
1
t1
II
40
3
t2
检查该装置气密性的方法是。
比较实验I和Ⅱ可以得出的结论是。
-
(2) (实验二)探究铁的电化学腐蚀。
①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面右侧液面(选填“上升”、“下降”)。
②圆底烧瓶中装与①相同量的铁粉但不加入碳粉,其他试剂和操作相同,发现左、右侧液面变化较(选填“快”、“慢”,下同),说明原电池反应比一般化学反应。
③圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是:,正极的电极反应是。

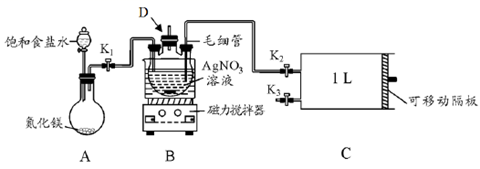
-
(1) I.配制银氨溶液
盛装AgNO3溶液的仪器D的名称。
-
(2) 关闭K2和K3 , 打开K1和分液漏斗活塞,将饱和食盐水滴入到圆底烧瓶中,当观察到D中最初生成的白色沉淀恰好完全溶解时,关闭K1和分液漏斗活塞。请写出A装置中发生反应的化学方程式;饱和食盐水的用途是。
-
(3) Ⅱ.测定室内空气中甲醛含量
用热水浴加热D,打开K3 , 将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3 , 后续操作是。
-
(4) 装置中毛细管的作用是。
-
(5) 已知甲醛被银氨溶液氧化的化学方程式为:HCHO+4Ag(NH3)2OH=(NH4)2CO3+4Ag↓+6NH3↑+2H2O,测得共生成Ag 2.16mg。则空气中甲醛的含量为mg.L-1(空气中其它物质不与银氨溶液反应)。
-
(6) 该设计装置存在一个明显的不足之处是。

已知:①2NO+Na2O2 =2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO  ;
;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3 +2NO↑+ H2O。
回答下列问题:
-
(1) A中盛Na2O2的玻璃仪器名称是。
-
(2) 上述实验装置中,依据气流从左至右,装置连接顺序(可重复使用)为。
-
(3) 连接仪器并检查气密性,检查气密性的具体操作是。
-
(4) 打开活塞K2之前先通入氮气,其理由是。
-
(5) 实验时观察到C中溶液变为蓝色,其离子方程式为。
-
(6) 探究NaNO2性质:实验完毕后,甲同学取少量A中白色粉末(假设为纯净物)溶于水,并滴加几滴稀盐酸,然后加入KI淀粉溶液,溶液变蓝色,甲同学得出结论NaNO2有氧化性,乙同学认为甲同学的结论不严谨,其理由是。
-
(7) 家里腌制的咸菜中含有一定量的亚硝酸盐,为测定咸菜中亚硝酸根离子的含量,取1 kg咸菜榨汁,将榨出的液体收集后,加入提取剂,过滤得到无色滤液,将该滤液稀释至1 L,取50. 00 mL滤液与过量的稀硫酸和碘化钾溶液的混合液反应,再滴加几滴指示剂,用0. 100 mol·L-1 Na2S2O3溶液进行滴定,共消耗20. 00 mL。计算该咸菜中亚硝酸根离子的含量为mg·kg-1。
已知:①2NO
 +4H++2I- =2NO↑ +I2 +2H2O
+4H++2I- =2NO↑ +I2 +2H2O②I2+2Na2S2O3=2NaI+Na2S4O6
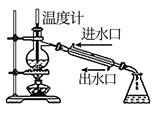
查阅资料得:实验室制取甲烷常用的方法为无水醋酸钠 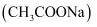 与氢氧化钠在二氧化锰作催化剂的条件下共热,产物中有少量的副产物丙酮
与氢氧化钠在二氧化锰作催化剂的条件下共热,产物中有少量的副产物丙酮 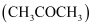 ,丙酮可与水混溶。
,丙酮可与水混溶。
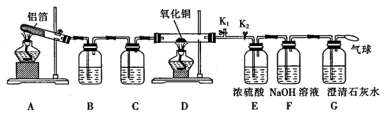
-
(1) 组装好仪器后,首先进行的操作是,实验中先点燃(填“A”或“D”)处酒精灯,此时
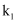 、
、  的状态为(填标号)。
的状态为(填标号)。 A.
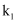 关闭、
关闭、  关闭 B.
关闭 B. 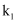 关闭、
关闭、  打开
打开C.
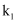 打开、
打开、  打开 D.
打开 D. 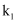 打开、
打开、  关闭
关闭 -
(2) 装置A中主要发生反应的化学方程式为,试管内壁加一层铝箔不仅能使药品受热均匀,还能。
-
(3) 装置B中盛装的试剂为。
-
(4) 实验过程中记录的实验数据如下:
实验前装置总质量/g
D
E
F
G
实验后装置总质量/g
180.0
277.8
311.5
301.0
实验前装置总质量/g
177.2
279.6
312.6
301.0
若装置D中的氧化铜全部被还原成铜,则气球中收集到的由D中反应产生的气体在标准状况下的体积为L,此条件下,装置D中发生反应的化学方程式为。
| A | B | C | D |
| | | | |
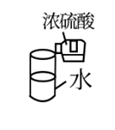
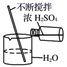
| 稀释浓硫酸 | 制备氨气 | 检查装置的气密性 | 制备蒸馏水 |
| 编号 | ① | ② | ③ | ④ |
| 操作示 意图 | | | | |
| 操作名称 | 倾倒液体 | 取用块状固体 | 稀释浓硫酸 | 检查气密性 |
A | B | C | D |
|
|
|
|
溶液的配制 | 氯气的净化 | 检查装置的气密性 | 沉淀的过滤 |