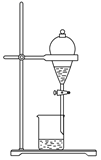
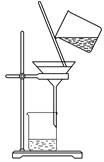
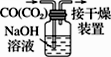分液和萃取 知识点题库
实验 | 现象 | 结论 | |
A | 向1mL FeCl3溶液中滴加1mLKI溶液,再加入1mLCCl4 , 振荡后静置。 | 溶液分层,上层溶液显紫色。 | 氧化性:Fe3+>I2 |
B | 将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。 | Al条产生气泡的速度快。 | 金属性:Al>Mg |
C | 向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。 | 得到红褐色透明液体。 | 制得了氢氧化铁胶体。 |
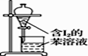
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。 | 溶液分为两层,上层为橙色。 | 溴在苯中的溶解能力大于水中。 |
|
|
|
|
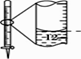
A.配制0.10 mol·L-1NaOH溶液 | B.苯萃取碘水中I2 , 分出水层后的操作 | C.除去CO中的CO2 | D.记录滴定终点读数为12.20mL |
合成反应: 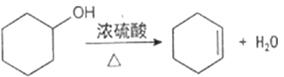
可能用到的有关数据如下:
|
相对分子质量 |
密度/(g·cm-3) |
沸点/℃ |
溶解性 |
|
|
环己醇 |
100 |
0.9618 |
161 |
微溶于水 |
|
环己烯 |
82 |
0.8102 |
83 |
难溶于水 |
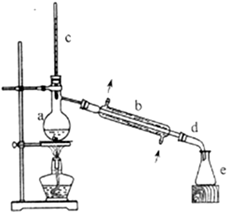
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
请回答下列问题:
-
(1) 装置b的名称是。
-
(2) 加入碎瓷片的作用是,如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是(填正确答案标号)。
A.立即补加
B.冷却后补加
C.不需补加
D.重新配料
-
(3) 本实验中最容易产生的副产物的结构简式为。
-
(4) 分液漏斗在使用前须清洗干净并;在本实验分离过程中,产物应该从分液漏斗的(填“上口倒出”或“下口放出”)
-
(5) 分离提纯过程中加入无水氯化钙的目的是。
-
(6) 在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填正确答案标号)。A . 蒸馏烧瓶 B . 温度计 C . 玻璃棒 D . 锥形瓶
-
(7) 本实验所得到的环己烯产率是有________(填正确答案标号)。A . 41% B . 50% C . 61% D . 70%

下列说法正确的是( )
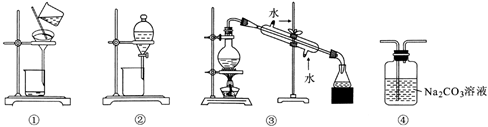
| A | B | C | D |
| | | | |
| 升华 | 分液 | 过滤 | 蒸馏 |
| | | | |
| 斩竹漂塘:斩取嫩竹放入池塘浸泡 | 煮徨足火:将浸泡后的竹料一起与石灰浸泡蒸煮 | 荡料入帘:竹料在水中荡料,竹浆成薄层附于竹上,余水沿竹帘边流下 | 覆帘压纸:抄纸后的竹帘倒铺在压板上、移开竹帘,重复多层后、重物挤压 |
资料1:25℃时,生成氢氧化物沉淀的pH
| Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Mg(OH)2 | Ca(OH)2 | Ni(OH)2 | |
| 开始沉淀时 | 6.3 | 1.5 | 6.2 | 9.1 | 11.8 | 6.9 |
| 完全沉淀时 | 8.3 | 2.8 | 8.2 | 11.1 | 13.8 | 8.9 |
注:金属离子的起始浓度为0.1mol/L.
资料2:25℃时,Ksp(CaF2)=4×10-11 , Ksp(MgF2)=9×10-9 , ZnF2易溶于水。
资料3:P204(二乙基己基磷酸)萃取金属离子的反应为:x 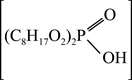 +Mx+
+Mx+ 
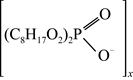 M+xH+
M+xH+
-
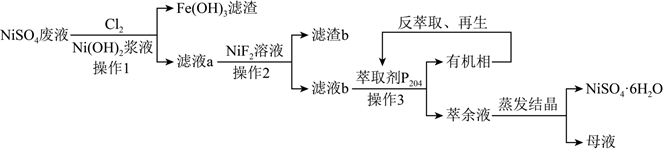
(1) 操作1、2的名称是,操作3的名称是。
-
(2) 操作1中加入Cl2的主要目的是。
-
(3) NiF2溶液参与反应的离子方程式是。杂质离子沉淀完全时,溶液中c(F-)=mol/L(c(杂质离子)≤10-5mol/L即可视为沉淀完全)。
-
(4) 滤液b中含有的微粒主要有。
-
(5) 在硫酸盐溶液中,P204对某些金属离子的萃取率与pH关系如图所示,在一定范围内,随着pH升高,萃取率升高的原因是。
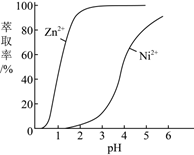
-
(6) 在母液中加入其它物质,可制备操作1中所需Ni(OH)2浆液,写出制备的离子方程式。