配制一定物质的量浓度的溶液 知识点题库
-
(1) 主要仪器
托盘天平、量筒、烧杯、玻璃棒、胶头滴管,还需要的玻璃仪器是
-
(2)
配制步骤
①计算:根据n=c•V,m=n•M,则m(NaCl)= g.
②称量:用托盘天平准确称取NaCl固体 g.
③溶解:将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解;用玻璃棒搅拌,并冷却至室温.
④移液:
⑤洗涤:用蒸馏水洗涤烧杯内壁及玻璃棒2﹣3次,并将洗涤液都注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀.
⑥定容:将蒸馏水注入容量瓶,当液面距容量瓶颈刻度线1 cm~2 cm时,
改用胶头滴管滴加蒸馏水至凹液面最低处与刻度线相切.
⑦摇匀:盖好瓶塞,反复上下颠倒,摇匀.
如图是该同学转移溶液的示意图,指出图中的错误:
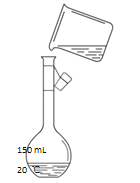
-
(3) 若实验遇到下列情况,对NaCl溶液的物质的量浓度有何影响(填写“偏高”、“偏低”或“不变”)?
①为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至容量瓶定容. .
②溶解的NaCl溶液转移到容量瓶中后未洗涤烧杯: .
③定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度.
-
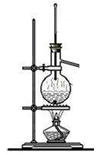
(1) 配制稀硫酸时,上述仪器中不需要使用的有(选填序号),还缺少的仪器有 (写仪器名称).
-
(2) 配制100mL 1mol•L﹣1的稀硫酸需要用量筒量取上述浓硫酸的 mL(保留一位小数).
-
(3) 实验中造成所配溶液浓度偏高的原因可能是 .A . 容量瓶中原来含有少量蒸馏水 B . 未经冷却,立即转移至容量瓶并洗涤烧杯,定容 C . 烧杯没有洗涤 D . 向容量瓶中加水定容时眼睛一直仰视刻度线.
成分 | 质量(g) | 摩尔质量(g•mol﹣1) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 3.48 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 1.58 | 158 |
硝酸银 | 0.02 | 170 |
-
(1) 下列“鲜花保鲜剂”的成分中,属于电解质的是 .A . 蔗糖 B . 硫酸钾 C . 高锰酸钾 D . 硝酸银
-
(2) “鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为.
-
(3) 配制上述“鲜花保鲜剂”用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少,(填写所缺仪器的名称).
-
(4) 配制溶液时有以下几个操作:
①溶解 ②摇匀 ③洗涤 ④冷却 ⑤称量 ⑥转移溶液 ⑦定容,
正确的操作顺序是(填序号).
-
(5) 若定容时俯视容量瓶刻度线,会使所配溶液浓度(填偏大、偏小、不变).
①用pH试纸测得氯水的pH为2
②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤干净
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤向沸腾的NaOH稀溶液中滴加氯化铁饱和溶液,可以制得氢氧化铁胶体
⑥实验室配制氯化亚锡溶液时,可以先将氯化亚锡溶解在盐酸中,再配制到所需的浓度.
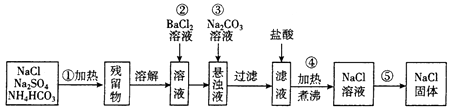
请根据操作流程回答下列问题:
-
(1) 操作①在加热时应选择盛装混合物(填仪器名称)。
-
(2) 进行操作②后,判断SO42-已沉淀完全的方法是。
-
(3) 操作③的离子方程式为。
-
(4) 操作④的目的是。
-
(5) 实验室进行操作⑤的具体步骤是。
-
(6) 某同学欲用制得的氯化钠固体配制100mL0.2mol·L-1的氯化钠溶液。
①配制NaCl溶液时需用到的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、。
②下列操作会使所配氯化钠溶液浓度偏小的是(请填序号)。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.在溶解过程中有少量液体溅出烧杯外
D.颠倒摇匀后发现凹液面低于刻度线又加水补上
 D . 配制一定物质的量浓度的溶液时,定容时俯视刻度线会导致所配溶液浓度偏高
D . 配制一定物质的量浓度的溶液时,定容时俯视刻度线会导致所配溶液浓度偏高
图① 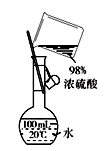 图②
图② 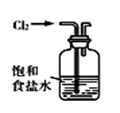 图③
图③ 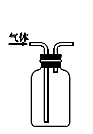
图④ 

-
(1) 该浓盐酸的物质的量浓度为
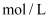 .
.
-
(2) 取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 ______ .A . 溶液中HCl的物质的量 B . 溶液的浓度 C . 溶液中Cl-的数目 D . 溶液的密度
-
(3) 某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为
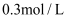 稀盐酸.
稀盐酸. 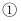 该学生需要量取 mL上述浓盐酸进行配制.
该学生需要量取 mL上述浓盐酸进行配制. 配制时,其正确的操作顺序是
配制时,其正确的操作顺序是  用字母表示,每个字母只能用一次
用字母表示,每个字母只能用一次  ;
;A.用30mL水洗涤烧杯
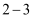 次,洗涤液均注入容量瓶,振荡
次,洗涤液均注入容量瓶,振荡B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水
 约
约 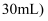 的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
的烧杯中,用玻璃棒慢慢搅动,使其混合均匀C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线
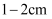 处
处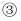 在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?  填“偏高”或“偏低”或“无影响”
填“偏高”或“偏低”或“无影响”  .
.I、用量筒量取浓盐酸时俯视观察凹液面
II、用量筒量取浓盐酸后,洗涤量筒
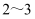 次,洗涤液也转移到容量瓶
次,洗涤液也转移到容量瓶 III、溶液注入容量瓶前没有恢复到室温就进行定容
-
(4) 若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为d
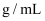 ,则此溶液的物质的量浓度为 ______
,则此溶液的物质的量浓度为 ______ 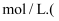 填字母
填字母  A .
A . B .
B . 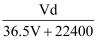 C .
C . 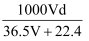 D .
D . 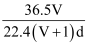
 B .
B . |
盐酸 |
|
|
分子式 |
HCl |
|
相对分子质量 |
36.5 |
|
密度 |
1.19g/mL |
|
HCl的质量分数 |
36.5% |
-
(1) 该浓盐酸中HCl的物质的量浓度为mol•L﹣1。
-
(2) 某学生欲用上述浓盐酸和蒸馏水配制450mL,物质的量浓度为0.400mol•L﹣1的稀盐酸,需用到的玻璃仪器有:烧杯,玻璃棒,胶头滴管,量筒 , 。该学生需要量取mL上述浓盐酸进行配制。
-
(3) 在容量瓶的使用方法中,下列操作错误的是_____(填写标号)。A . 使用容量瓶前检查它是否漏水 B . 容量瓶用蒸馏水洗净后,再用待配溶液润洗 C . 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,用胶头滴管加蒸馏水到标线 D . 摇匀后,容量瓶内溶液的液面下降,无需再加水
-
(4) 定容时仰视刻度线,对所配制的稀盐酸的物质的量浓度有何影响?
-
(1) 本实验用到的基本仪器中除托盘天平、药匙、烧杯、量筒、胶头滴管、玻璃棒外还有;
-
(2) 实验中称取NaCl晶体的质量是g(小数点后保留一位小数);
-
(3) 若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”、“偏低”、“无影响”)
A、定容时俯视;
B、加蒸馏水时不慎超过了刻度但迅速用胶头滴管吸出;
C、容量瓶未经干燥就使用 ;
D、用“左码右物”的称量方法称量晶体;
-
(1) 所得盐酸的物质的量浓度。
-
(2) 将生成的FeCl2配成400 mL溶液,此溶液中FeCl2的物质的量浓度是。



