物质的量的相关计算 知识点题库
下列叙述正确的是( )
A . 1 mol H2O 的质量为18g/mol
B . CH4 的摩尔质量为16g
C . 3.01×1023 个SO2 分子的质量为32g
D . 标准状况下,1 mol 任何物质的体积均为22.4L
发射卫星的火箭推进器中大多使用燃料偏二甲肼,其化学式C2H8N2 . 计算:
-
(1) 偏二甲肼的摩尔质量是;480g偏二甲肼的物质的量为.
-
(2) 偏二甲肼中碳原子与氮原子的个数之比是,其物质的量之比是;1mol偏二甲肼中含有的氢原子数目是.
某溶液中只含有K+、Na+、NO3﹣、SO42﹣四种离子(不考虑水的电离)它们的物质的量之比为1:6:3:2,该溶液所含的溶质可能是( )
A . KNO3、Na2SO4
B . K2SO4、NaNO3、KNO3
C . KNO3、Na2SO4、NaNO3
D . K2SO4、Na2SO4、KNO3
在下列条件下,两种气体的分子数一定相等的是( )
A . 同温度、同体积的N2和O2
B . 同压强、同体积的H2和CH4
C . 同质量、不同密度的N2和CO
D . 同体积、同密度的CO2和N2
下列选项中能表示阿伏加德罗常数数值的是( )
A . 1 mol H+含有的电子数
B . 标准状况下,22.4 L酒精所含的分子数
C . 1.6 g CH4含有的质子数
D . 1 L 1 mol·L-1的硫酸钠溶液所含的Na+数
阿伏加德罗常数的值为NA , 下列说法正确的是( )
A . 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B . 1 L1 mol·L-1HCl溶液中含有NA个HCl分子
C . 12.0 g熔融的NaHSO4中含有的阳离子数为0.1NA
D . 1mol SO2与足量O2在一定条件下充分反应生成SO3 , 共转移2 NA个电子
如下图所示的是某溶液稀释过程中,溶液的物质的浓度随溶液体积的变化曲线图,根据图中数据分析得出a值等于( )

A . 2
B . 3
C . 4
D . 5
现有0.27kg质量分数为10%的CuCl2溶液。试计算:
-
(1) 溶液中CuCl2的物质的量;
-
(2) 溶液中Cu2+和Cl-的物质的量。
已知NaHSO4溶于水时电离出Na+、H+、SO42- , 某同学欲探究其化学性质,称取了12.0gNaHSO4 , 固体配成100mL溶液,做了如下实验:
①取20mL该溶液加入足量Zn粒有大量气体生成;
②取20mL该溶液加入Fe2O3后溶液变黄色;
③取20mL该溶液加入BaCl2溶液后有大量白色沉淀产生。
请回答下列问题:
-
(1) 该实验所配置的NaHSO4溶液物质的量浓度为。
-
(2) 请用离子方程式解释①中的实验现象,该实验过程中产生的气体体积为(请按标准状况下计算)。
-
(3) 请用离子方程式解释②中的实验现象。
-
(4) 请用离子方程式解释③中的实验现象。
将2.3g钠放入91.8g水中,反应完全后,溶液中Na+与H2O分子的个数比为( )
A . 1︰30
B . 1︰40
C . 1︰50
D . 1︰51
科学家制得一种新型分子O4。关于O4和O2的说法错误的是( )
A . 互为同素异形体
B . 等质量的O4和O2所含原子数相同
C . 它们的摩尔质量相同
D . 等物质的量的O4和O2所含原子数之比为2:1
物质的量是联系宏观的和微观的桥梁。
-
(1) 标准状况下,与5.6L的CH4气体含相同H原子数的H2S的质量为g。
-
(2) 将0.2mol·L-1Al2(SO4)3和0.2mol·L-1H2SO4溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中c (SO
 )=mol·L-1。若用容量瓶以质量分数为98%、密度为1.84g·cm-3的浓硫酸,配制500mL浓度成0.2mol·L-1稀硫酸,计算需要量取mL的浓硫酸。
)=mol·L-1。若用容量瓶以质量分数为98%、密度为1.84g·cm-3的浓硫酸,配制500mL浓度成0.2mol·L-1稀硫酸,计算需要量取mL的浓硫酸。
-
(3) 某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1︰4︰8。
①配制该营养液后c(NH
 )=0.016mol·L-1 , 溶液中c(K+)=。
)=0.016mol·L-1 , 溶液中c(K+)=。②若采用(NH4)2SO4和KCl来配制该营养液,则(NH4)2SO4和KCl物质的量之比为。
已知15gA物质和10.5gB物质恰好完全反应生成7.2gC、1.8gD和0.3molE,则E物质的摩尔质量是( )
A . 100g/mol
B . 111g/mol
C . 55g/mol
D . 55g
简单计算题,只填写结果。
-
(1) 标准状况下33.6 L H2中,所含质子个数是。
-
(2) 所含电子的物质的量为4mol的H2 , 标况下的体积是。
-
(3) 20℃时45gH2O ,所含原子个数是。
-
(4) 标况下,16gO2与14gN2的混合气体所占的体积是。
-
(5) 含原子总数约为1.204×1024的NH3 的质量是 。
下列物质中,物质的量最小的是( )
A . 常温常压下  B . 标准状况下
B . 标准状况下 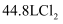 C .
C . 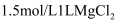 溶液中含有的
溶液中含有的  D .
D .  个
个 
 B . 标准状况下
B . 标准状况下 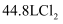 C .
C . 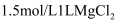 溶液中含有的
溶液中含有的  D .
D .  个
个 
在下面的横线上填上适当的内容。
-
(1) 6.02×1023个Na+的物质的量为,其质量为。
-
(2) NO2的摩尔质量为,标准状况下,1molNO2的气体体积为。
-
(3) 标准状况下,1molCO2的体积,含有CO2分子个数。
-
(4) 配制500mL1mol/LNa2CO3溶液,Na2CO3的物质的量为,需要Na2CO3的质量为。
448 mL某气体在标准状况下的质量为1.28 g,该气体的摩尔质量为( )
A . 64 g
B . 64
C . 64 g·mol-1
D . 32 g·mol-1
用 表示阿伏加德罗常数的数值,下列说法正确的是( )
表示阿伏加德罗常数的数值,下列说法正确的是( )
 表示阿伏加德罗常数的数值,下列说法正确的是( )
表示阿伏加德罗常数的数值,下列说法正确的是( )
A . 常温常压下,48g  和
和 含有的氧原子数均为3
含有的氧原子数均为3 B . 标准状况下,22.4L
B . 标准状况下,22.4L  含有的分子数为
含有的分子数为 C . 标准状况下,11.2L
C . 标准状况下,11.2L 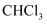 中含有
中含有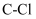 键的数目为0.5
键的数目为0.5 D . 2.7g铝与足量氢氧化钠溶液反应转移的电子数为
D . 2.7g铝与足量氢氧化钠溶液反应转移的电子数为
 和
和 含有的氧原子数均为3
含有的氧原子数均为3 B . 标准状况下,22.4L
B . 标准状况下,22.4L  含有的分子数为
含有的分子数为 C . 标准状况下,11.2L
C . 标准状况下,11.2L 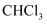 中含有
中含有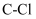 键的数目为0.5
键的数目为0.5 D . 2.7g铝与足量氢氧化钠溶液反应转移的电子数为
D . 2.7g铝与足量氢氧化钠溶液反应转移的电子数为
用10mL0.1mol·L-1BaCl2溶液恰好可分别使相同体积的Fe2(SO4)3、K2SO4和ZnSO4三种溶液中的SO 完全转化为BaSO4沉淀,则三种硫酸盐溶液物质的量浓度之比是( )
完全转化为BaSO4沉淀,则三种硫酸盐溶液物质的量浓度之比是( )
 完全转化为BaSO4沉淀,则三种硫酸盐溶液物质的量浓度之比是( )
完全转化为BaSO4沉淀,则三种硫酸盐溶液物质的量浓度之比是( )
A . 1∶3∶3
B . 1∶2∶3
C . 3∶2∶2
D . 3∶1∶1
回答下列问题
-
(1)
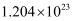 个NH
个NH 的物质的量为mol
的物质的量为mol
-
(2) 在9.5g某二价金属的氯化物中含有0.2mol
 , 该金属元素的相对原子量为。
, 该金属元素的相对原子量为。
-
(3) 在标准状况下,由CO和
 组成的混合气体为6.72L,质量为12g,此混合物中C和O原子个数比是。
组成的混合气体为6.72L,质量为12g,此混合物中C和O原子个数比是。
-
(4) 0.3mol
 分子中所含原子数与个
分子中所含原子数与个 分子中所含原子数相等。
分子中所含原子数相等。
最近更新



