氧化还原反应 知识点
氧化还原反应 知识点题库
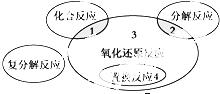
 Na2CO3+H2O+CO2↑
C . 4NH3+5O2
Na2CO3+H2O+CO2↑
C . 4NH3+5O2  4NO+6H2O
D . Zn+H2SO4═ZnSO4+H2↑
4NO+6H2O
D . Zn+H2SO4═ZnSO4+H2↑
-
(1) 若剩余的4.80g固体全是MnO2 , 则原混合物中KClO3的质量为g;
-
(2) 若剩余的4.80g固体是MnO2和KCl的混合物
(a)求25℃时KCl的溶解度;
(b)求原混合物中KClO3的质量;
(c)所得KCl溶液的密度为1.72g/cm3 , 则溶液的物质的量浓度为多少?(保留2位小数)
-
(1) 人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述错误的是________(填序号)。A . 亚硝酸盐被还原 B . 维生素C是还原剂 C . 维生素C将Fe3+还原为Fe2+ D . 亚硝酸盐是还原剂
-
(2) 下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。A . 加入稀盐酸,观察是否有气泡产生 B . 分别蘸取少量溶液在酒精灯上灼烧,观察颜色 C . 在酸性条件下加入KI—淀粉溶液来区别 D . 用AgNO3和HNO3两种试剂来区别
-
(3) 某同学把氯气通入到NaNO2溶液中,生成NaNO3和HCl,请写出反应的离子方程式:。
-
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+ , 要求产物纯净,可选用的最佳试剂是(填序号)。
a.Cl2
b.Fe
c.H2O2
d.HNO3
-
(5) 若FeSO4和O2的化学计量数比为2∶1,试配平下列方程式:
FeSO4+K2O2-+K2FeO4+K2O+K2SO4+O2↑
-
(6) 高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是。
-
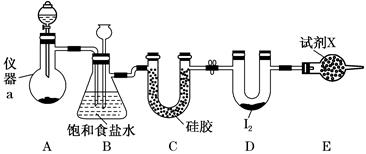
(1) 仪器a的名称是。
-
(2) 制备氯气选用的药品为漂白精固体[主要成分为Ca(ClO)2]和浓盐酸,相关反应的化学方程式为。
-
(3) 装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时装置B中的现象:。
-
(4) 试剂X为。
-
(5) 氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为。
-
(6) 500mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管,170℃下充分反应,用水-乙醇混合液充分溶解产物I2 , 定容到100mL。取25.00mL用0.0100mol·L-1Na2S2O3标准溶液滴定,消耗标准溶液20.00mL,则样品中CO的体积分数为。(保留三位有效数字)(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)
 Na2CO3+H2O+x , 则x的化学式是( )
Na2CO3+H2O+x , 则x的化学式是( )
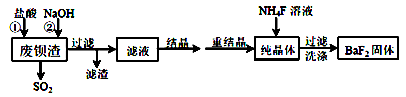
已知:Ksp(BaS2O3)=6.96×10-11 , Ksp(BaF2)=1.0×10-6
-
(1) 加入盐酸时除产生SO2外,还有淡黄色固体生成。该反应的离子方程式为。
-
(2) 滤液的主要成分有。(填化学式)
-
(3) 工业上可用氨水吸收SO2 , 并通入空气使其转化为铵态氮肥。该转化中氧化剂与还原剂的物质的量之比为。
-
(4) 加入NaOH溶液的目的是中和过量的盐酸,但不宜过量,其原因是(用离子反应方程式表示)。
-
(5) 生成BaF2的反应的化学方程式为。
①若该反应温度过高,容易造成c(F-)降低的原因是。
②研究表明,适当增加NH4F的比例有利于提高BaF2的产率和纯度。将浓度为0.1 mol•L-1的BaCl2溶液和0.22mol•L-1NH4F溶液等体积混合,所得溶液中c(Ba2+)=。
-
(1) Ⅰ.①H2+CuO
 Cu+H2O
Cu+H2O ②CaCO3+2HCl=CaCl2+CO2↑+H2O
③3S+6NaOH
 2Na2S+Na2SO3+3H2O
2Na2S+Na2SO3+3H2O ④NH4NO3+Zn=ZnO+N2↑+2H2O
⑤Cu2O+4HCl=2HCuCl2+H2O
上述反应中,属于氧化还原反应的是(填序号)。
-
(2) 配平下面氧化还原反应的化学方程式:KMnO4+SO2+H2O—K2SO4+MnSO4+H2SO4 。
-
(3) Ⅱ.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+中的几种离子。
不做任何实验就可以肯定原溶液中不存在的离子是。
-
(4) 取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,原溶液中肯定有的离子是。
-
(5) 取(4)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有,离子反应方程式为。
-
(6) 原溶液中可能大量存在的阴离子是下列的________(填序号)。A . Cl- B .
 C .
C .  D . OH-
D . OH-
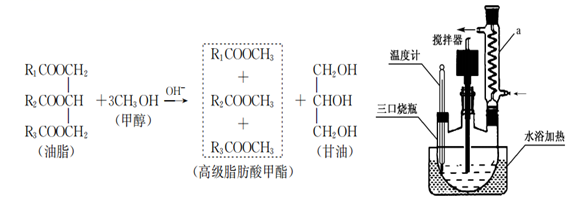
①称取4.6g CH3OH和0.2g NaOH依次放入锥形瓶中,充分震荡得NaOH溶液甲醇溶液;
②将20g 菜籽油、20g正己烷(作溶剂)、步骤1配得的NaOH甲醇溶液一次加入到三口烧瓶中;
③安装装置(如图)恒温水浴加热,使温度保持在60~65℃左右,搅拌速度400r/min,回流1.5h~2h;
④冷却、分液、水洗、回收溶剂并得到生物柴油。
回答下列问题:
-
(1) 仪器a的名称是 。
-
(2) 试验中取用的甲醇与油脂的物质的量之比约为6:1,甲醇过量的主要目的是;NaOH的用量不宜过多,其原因是。
-
(3) 步骤4的液体分为两层,上层为生物柴油、正己烷和甲醇。下层主要为甘油、分离出下层液体的方法是 ;上层液体需用温水洗涤,能说明已洗涤干净的依据是。
-
(4) 碘值是指每100g油品所能吸收碘(I2)的质量。测定产品碘值得步骤如下:
I.准确称取m g 油品,注入碘量瓶中,向碘量瓶中加入20 mL氯仿溶解后,加入25.00mL韦氏碘液,(IBr溶液及催化剂,发生反应:
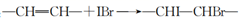 ),立即加塞,摇匀后,将碘量瓶放于黑暗处。
),立即加塞,摇匀后,将碘量瓶放于黑暗处。II.30min 后立即加入20 mL 15%的碘化钾溶液和100 mL水,发生反应的化学方程式为 ,不断震荡,用c mol·L-1 的Na2S2O3溶液滴定至溶液呈浅黄色时,加入1mL 淀粉指示剂,继续滴定(I2 + 2Na2S2O3=2NaI+Na2S4O6),至终点是消耗V1 mL Na2S2O3溶液。滴定终点的现象是 。
III.另做空白对照试验,除不加油品外,其余操作同上,至终点时消耗V2 mL Na2S2O3溶液。则测得的油品的碘值为 g/100g (列出计算表达式)
-
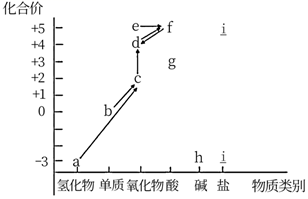
(1) 下列说法正确的是
a、可通过雷电作用将b转化为c,这是一种固氮方式
b、可通过加氧化剂将e转化为f
c、a→c→d→f这几个反应中,均发生了N元素被氧化的反应
d、g只具有氧化性,还可能与碱发生反应
e、可通过加Cu、C等还原剂,将f转化为d
f、h可与f反应生成i
-
(2) a的电子式为,写出a转化为c的化学方程式
-
(3) h的化学式是,检验i中阳离子的方法是
-
(4) f的稀溶液与Cu反应的离子方程式为标准状况下生成4.48L气体,参加反应的铜的质量为
| 选项 | 操作、现象 | 解释 |
| A | 向KI-淀粉溶液中加入FeCl3溶液,溶液变蓝 | Fe3+能与淀粉发生显色反应 |
| B | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5%H2O2溶液 | 探究浓度对反应速率的影响 |
| C | 常温下,用pH试纸分别测定浓度均为0.1 mol·L-1的NaF溶液和NaClO溶液的pH | 比较HF与HClO的酸性强弱 |
| D | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成红棕色的NO2能溶于浓硝酸 |
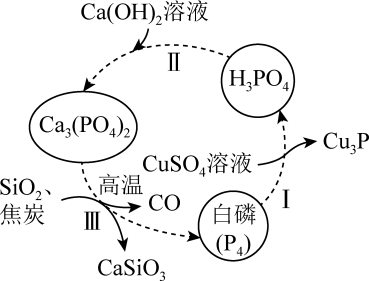
 的空间结构为正四面体形
C . 过程Ⅰ、Ⅱ、Ⅲ中发生的均为氧化还原反应
D . 流程中所涉及元素的基态原子未成对电子数最多的是P
的空间结构为正四面体形
C . 过程Ⅰ、Ⅱ、Ⅲ中发生的均为氧化还原反应
D . 流程中所涉及元素的基态原子未成对电子数最多的是P
 构成的晶体NaxNO4 , 测定阴离子NO
构成的晶体NaxNO4 , 测定阴离子NO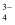 中的各原子的最外层电子都达到了8电子稳定结构。下列说法错误的是( )
中的各原子的最外层电子都达到了8电子稳定结构。下列说法错误的是( )
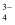 中N和硝酸根中N化合价相同
D . 此反应是非氧化还原反应
中N和硝酸根中N化合价相同
D . 此反应是非氧化还原反应



