探究铝与酸、碱溶液的反应 知识点题库
-
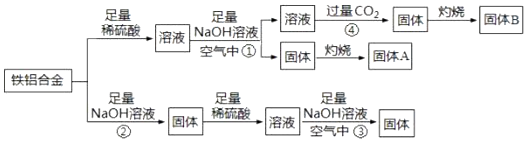
(1) 铁铝合金是一种高电磁性能合金,下列有关推测可能正确的是_____(填序号).A . 铁铝合金可由铁和铝熔融混合制成 B . 铁铝合金的熔点高于铝和铁 C . 铁铝合金硬度高于纯铝
-
(2) 反应①中铝元素发生反应的离子方程式为.
-
(3) 反应②的化学方程式为.
-
(4) 反应③发生时观察到的现象是.
-
(5) 反应④中的CO2不宜换成HCl,原因是.
-
(6) 请分别举出固体A和B的一种用途、.
 完全转化为
完全转化为 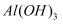 沉淀,选用的最佳试剂是
沉淀,选用的最佳试剂是
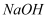 溶液
B . 稀盐酸
C . 氨水
D .
溶液
B . 稀盐酸
C . 氨水
D . 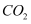
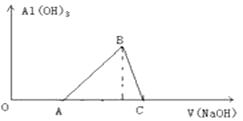
①将NaOH溶液分多次加到AlCl3溶液中;
②将AlCl3溶液分多次加到NaOH溶液中,
比较两种操作的结果是()
⑴铝 ⑵氧化铁 ⑶氧化铝 ⑷氢氧化铝
(查阅资料)铁、铜不与氢氧化钠溶液反应。
-
(1) (猜想)猜想1:该合金粉末中,除含铝外,还含有铁。
猜想2:该合金粉末中,除含铝外,还含有铜。
猜想3:该合金粉末中,除含铝外,还含有(填名称)。
-
(2) (实验探究)下列实验仅供选择的试剂是:10%的盐酸、30%的氢氧化钠溶液。
实验方案
实验现象
结论
①取一定量的合金粉末,加过量的,充分反应后过滤,滤渣备用。
粉末部分溶解,并有气体放出。
合金中一定含有铝。
②取步骤①所得滤渣,加过量的,充分反应。
滤渣粉末部分溶解,并有气体放出,溶液呈现浅绿色。
合金中一定含有。
-
(3) (探究结论)猜想3成立。
(反思)一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与氢氧化钠溶液反应的离子方程式。
-
(4) (知识延伸)在一定条件下,铁和铝都能与水反应。写出在相应条件下,铁和水发生反应的化学方程式。
-
(1) I.研究铝的化学性质
铝在常温下会与氧气反应,表面形成一层致密的氧化膜,化学方程式为。实验前,需要对铝的表面先进行(填操作)处理。兴趣小组同学将铝处理好后剪成若干大小相同的小片,用于后续实验。
-
(2) 铝和酸、碱、盐溶液的反应
实验
操作
现象
结论
一
将铝片放入稀盐酸中
( ),试管变烫
铝能与盐酸发生反应,反应放热
二
将铝片放入氢氧化钠溶液中
铝表面有气泡产生试管变烫
铝能与氢氧化钠溶液反应,反应放热
三
将铝放入硫酸铜溶液中
铝表面有红色物质产生,溶液逐渐变成无色
金属活动性:铝( )铜
实验一的现象为。
实验二查阅资料:铝和氢氧化钠、水反应生成偏铝酸钠(NaAlO2)和氢气,反应的化学方程式为。实验三表明,铝的金属活动性(填“大于“或”小于“)铜。
-
(3) 小组同学将实验一中的稀盐酸换成等质量、氢离子浓度相同的稀硫酸,相同时间内发现铝片表面产生的气泡较少,反应较慢。对比上述两组实验产生猜想。猜想①:稀盐酸中的氯离子对反应可能有促进作用。猜想②:。为验证猜想①是否合理,应在铝和稀硫酸中加入(填字母),观察现象。
A.Na2SO4 B.Na2CO3 C.NaCl
-
(4) II.测定某铝样品中金属铝的质量分数
(资料1)氢氧化铝能与氢氧化钠溶液反应,但不与氨水反应。
(资料2)AlCl3+3NaOH=Al(OH)3↓+3NaCl;AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl。
小组同学称取4.62g某金属铝样品(样品中杂质仅为氧化铝),置于图一烧瓶中,加入足量稀盐酸至完全反应。将反应后的液体分成溶液1和溶液2两等份,设计两种实验方案(如图三),通过沉淀质量测定样品中金属铝的质量分数。
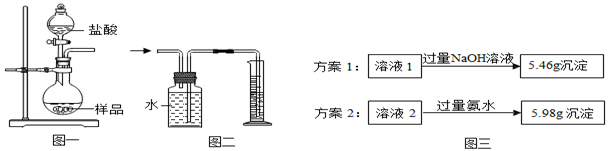
①选择正确的一种实验方案,计算样品中金属铝的质量分数(请写出计算过程)。。
②小组同学组合图一和图二装置测氢气体积,烧瓶中反应停止即读出量筒内水的体积,计算后发现金属铝的质量分数偏大,可能的原因是。
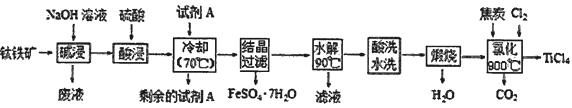
已知:
①酸浸 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
②水解 TiOSO4(aq)+2H2O(l) 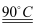 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
③煅烧 H2TiO3(s)  TiO2(s)+H2O(s)
TiO2(s)+H2O(s)
-
(1) FeTiO3中钛元素的化合价为,试剂A为。
-
(2) 碱浸过程发生反应的离子反应方程式为。
-
(3) 酸浸后需将溶液温度冷却至70℃左右,若温度过高会导致最终产品吸收率过低,原因是。
-
(4) 上述流程中氯化过程的化学反应方程式为。
已知TiO2(s)+2Cl2(g)
 TiCl4(l)+O2(g) △H=+151kJ·mol-1。该反应极难进行,当向反应体系中加入碳后,则反应在高温条件下能顺利发生。从化学平衡的角度解释原因是。
TiCl4(l)+O2(g) △H=+151kJ·mol-1。该反应极难进行,当向反应体系中加入碳后,则反应在高温条件下能顺利发生。从化学平衡的角度解释原因是。 -
(5) TiCl4极易水解,利用此性质可制备纳米级TiO2·xH2O,该反应的化学反应方程式是。
-
(1) 这三种金属中金属活动性最强的是 (填元素符号)
-
(2) 画出铝的原子结构示意图 。
-
(3) 写出氯化铝的电离方程式 。
-
(4) 把一小块金属钠投入水中,观察到以下各种现象:钠浮在水面上,熔成闪亮的小球,四处游动,逐渐减少,直至消失。写出该反应的化学方程式;其中钠熔成闪亮小球的原因是。钠完全反应后,收集到标准状况下的氢气2.24L,则参加反应的钠的物质的量为 mol。
-
(5) 将(4)所得溶液平均分成两份:
①一份加入足量的铝片充分反应,写出该反应的离子方程式:。
②向另一份溶液中滴加FeCl3溶液至沉淀不再增加,写出生成沉淀的反应的离子方程式;继续将沉淀过滤、洗涤、干燥、灼烧,此时得到的固体为(填化学式)。



