镁、铝的重要化合物 知识点
铝的重要化合物:氧化铝,白色固体,熔点高(2054℃),沸点2980℃,常作为耐火材料;是两性氧化物:既能与强酸反应又能与强碱反应生成盐和水的氧化物。Al2O3是工业冶炼铝的原料,由于氧化铝的熔点高,电解时,难熔化,因此铝的冶炼直到1886年美国科学家霍尔发现在氧化铝中加入冰晶石(Na3AlF6)。氢氧化铝,白色难溶于水的胶状沉淀,是两性氢氧化物,加热易分解。
镁、铝的重要化合物 知识点题库

①C,CO ②S,SO2 ③AlCl3、Al(OH)3 ④Na2CO3、NaHCO3 ⑤Fe、FeCl2 .
![]()
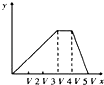 B .
B . 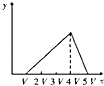 C .
C . 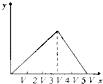 D .
D . 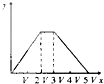
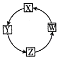
选项 | X | Y | Z | W |
A | Na | Na2O2 | NaOH | NaCl |
B | H2S | SO2 | SO3 | H2SO4 |
C | Fe | FeCl3 | Fe(OH)3 | Fe2O3 |
D | AlCl3 | NaAlO2 | Al(OH)3 | Al |
( )
-
(1) 我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料。请用离子方程式来证明它是一种两性氧化物:、.
-
(2) 取等质量的两份某镁铝合金分别加入足量的稀盐酸和氢氧化钠溶液中,产生的标准状况下H2体积分别为33.6L、22.4L则该合金中镁,铝的物质的量之比为。
-
(3) Cl2O为国际公认高效安全灭菌消毒剂,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,补充完整并配平方程式:__Cl2+Na2CO3+= NaHCO3+NaCl+Cl2O。
-
(1) 实验室用于盛放碱性试剂的试剂瓶不用磨口玻璃塞的原因是(用离子方程式表示):;玻璃试剂瓶不能盛放氢氟酸的原因是(用化学方程式表示):。
-
(2) 实验室中的Na2SiO3溶液长期放置,瓶底会出现白色沉淀,则形成沉淀的离子方程式是。取瓶中的上层清液加入稀盐酸,观察到既有气泡产生又有沉淀生成,其离子方程式分别为。用Na2SiO3溶液浸泡过的棉花不易燃烧,体现Na2SiO3的用途可做的原料。
-
(3) 某溶液中有NH4+、Mg2+、Fe2+、Fe3+、Al3+五种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是,有所增加的阳离子是。
A. NH4+
B. Mg2+
C. Fe2+
D. Al3+
E. Fe3+
-
(4) 质量相同的H216O和D216O所含质子数之比为 , 中子数之比为。
-
(5) A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为。

已知:Al(OH)3、Mn(OH)2、MnCO3的Ksp分别为1.0×10-33、1.9×10-13、2.2×10-11。
-
(1) “还原酸浸”时氧化产物为CO2 , 发生反应的化学方程式为。
-
(2) “还原酸浸”实验中,锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件为 。

-
(3) 滤液Ⅰ中的阳离子组成见下表:
组成
Mn2+
Fe2+
Fe3+
Al3+
浓度/(mol·L-1)
0.85
2.4×10-3
1.0×10-2
2.0×10-3
“除杂”时先加MnO2 , MnO2的作用为 。
再加氨水调节pH使杂质离子沉淀完全,通过计算说明Al3+沉淀完全时Mn2+是否开始沉淀 。
-
(4) “沉锰”时发生反应的离子方程式为 。
-
(5) “沉锰”的关键操作有2点:①将NH4HCO3溶液滴入MnSO4溶液中;②反应终点pH=7。如果颠倒试剂滴加顺序,将MnSO4溶液滴人NH4HCO3 , 溶液中,或反应终点pH>7可能造成同样的后果,该后果是;如粜反应终点pH<7,可能的后果是。
-
(6) 从滤液2中回收得到的副产品的用途为。
 B .
B .  C .
C .  D .
D . 
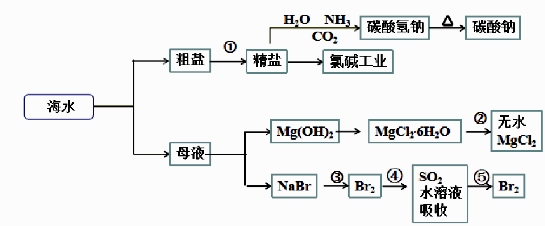
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
下列有关说法正确的是( )
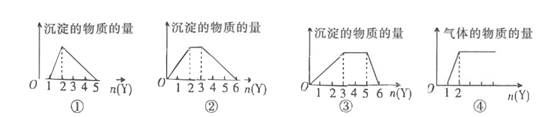
①氧化铝是一种比较好的耐火材料,可用来制造耐火坩埚
②氧化铁常用于制作红色油漆和涂料
③碳酸氢钠俗名小苏打,可用于制作发酵粉和治疗胃酸过多的药物
④过氧化钠比氧化钠稳定,两种氧化物均可作潜艇中的供氧剂
⑤焰色反应体现的是某些金属元素的物理性质
-
(1) 下列说法正确的是(填序号)。
① 配制氯化铁溶液,先将FeCl3固体溶于较浓盐酸,再用蒸馏水稀释到所需的浓度
② FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
③ 利用氯水和KSCN溶液可以检验Fe3+中有无Fe2+
④ 加热蒸干Fe2(SO4)3溶液获得Fe2(SO4)3固体
⑤ 含a mol AlCl3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成Al(OH) 3的质量相等
⑥ 由于金属铝性质稳定,所以Al在空气中能稳定存在
-
(2) 高铁酸钾(K2FeO4)是一种高效多功能水处理剂。其作用原理为。
-
(3) 以铝土矿(主要成分为Al2O3和Fe2O3、SiO2)为原料制备铝的一种工艺流程如下:

①滤渣主要成分为
②在实验室灼烧操作应选择的实验仪器为
③反应II中,加入NaHCO3一段时间才有沉淀生成,写出加入少量NaHCO3时发生反应的离子方程式。
-
(4) 已知25 ℃时Ksp[Cu(OH)2]=2.2×10−20 , Ksp[Fe(OH)3]=4.0×10−38 , Ksp[Al(OH)3]=1.1×10−33。
①在25 ℃下,向浓度均为0.1 mol·L−1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×10−5 mol·L−1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L−1。此时所得沉淀中(填“还含有”或“不含有”)Al(OH)3。
 B .
B . 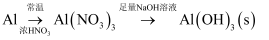 C .
C . 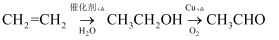 D .
D . 



