铜及其化合物 知识点
铜的化合物:氧化铜,黑色固体,不溶于水,属于碱性氧化物,能和酸(如盐酸)反应,能被H2、C等还原。
氧化亚铜:物理性质:红色粉末,不溶于水,能在酸性条件下发生铜元素的歧化反应,能被H2、C等还原。
氢氧化铜:蓝色固体,不溶于水,氢氧化铜属于二元弱碱,能和酸(如盐酸)反应。 氢氧化铜不稳定,受热易分解,化学方程式为:
氢氧化铜具有弱氧化性,新制Cu(OH)2悬浊液能和含有醛基的有机物反应.
硫酸铜为蓝色晶体,俗称蓝矾、胆矾,无水CuSO4遇水变蓝色(生成CuSO4·5H2O),可作为水的检验依据。
铜及其化合物 知识点题库
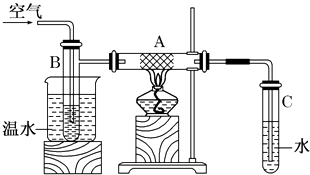
-
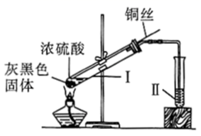
(1) 撤去A处酒精灯后铜丝仍然能保持红热的原因是;
-
(2) 反应后将试管C中的液体冷却,取出少量,加入到新制的Cu(OH)2悬浊液中,加热到沸腾可观察到现象是,写出反应的化学方程式.
反应阶段 | 溶液中的存在的金属离子 | 残留的金属粉末 | 发生的离子反应 |
第一阶段 | 只有一种 | 有两种 | (1) |
第二阶段 | 只有一种 | 只有一种 | |
第三阶段 | 只有两种 | (2) | (3) |
笫四阶段 | 有三种 | (4) | |
笫五阶段 | (5) |
回答以下问题:
-
(1) 写出第一阶段可能发生的离子反应方程式.
-
(2) 第三阶段金属粉末是否有残留.选填(“一定有”、“一定没有”、“可能有”)
-
(3) 第三阶段发生的离子反应方程式是(和以上(1)中重复的不写).
-
(4) 第四阶段金属粉末是否有残留?.选填(“一定有”、“一定没有”、“可能有”)
-
(5) 第五阶段溶液中存在的金属阳离子是(写出离子符号).
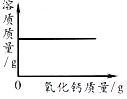 向一定量的饱和石灰水中加入氧化钙
B .
向一定量的饱和石灰水中加入氧化钙
B . 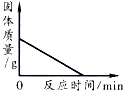 加热一定量高锰酸钾固体产生氧气
C .
加热一定量高锰酸钾固体产生氧气
C . 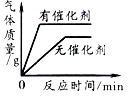 用一定量的双氧水制取氧气
D .
用一定量的双氧水制取氧气
D . 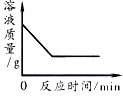 向一定量的硝酸银溶液中插入铜丝
向一定量的硝酸银溶液中插入铜丝

-
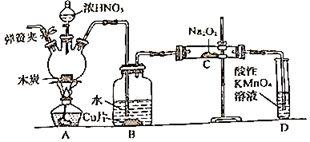
(1) 写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:
-
(2) “矿渣”中除了S以外,还有(填化学式);“回收S”过程中温度控制在50~60℃之间,不宜过高或过低的原因是
-
(3) “保温除铁”过程中,加入CuO的目的是;“蒸发浓缩、冷却结品”过程中,要用HNO3溶液调节溶液的pH,其理由是
-
(4) 气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为;向“滤液M”中加入(或通入) (填母代号),可得到另一种流程中可循坏利用的物质。
a.铁
b.氯气
c.高锰酸钾
已知:
室温下,①2NO+Na2O2=2NaNO2
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2ˉ都能与MnO4ˉ反应生成NO3ˉ和Mn2+
回答下列问题:
-
(1) 检查完该装置的气密性,装入药品后,实验开始前通入一段时间N2 , 然后关闭弹簧夹,再滴加浓硝酸,加热。通入N2的作用是。
-
(2) 装置B中观察到的主要现象为,发生反应离子方程式是。
-
(3) 装置D的作用是,发生反应的离子方程式是。
-
(4) 预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和(写化学式)。为避免产生这些副产物,应在装置B、C间增加干燥管,则干燥管中盛放的试剂为(写名称)。
-
(5) 利用改进后的装置将3.12gNa2O2完全转化为NaNO2 , 理论上至少需要木炭g
回答下列问题:
-
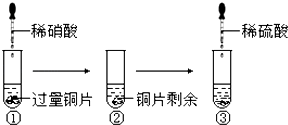
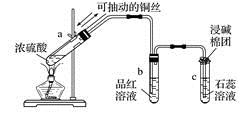
(1) 指出试管a、b、c中产生的实验现象:
①a中;
②b中;
③c中。
-
(2) 将a试管中的溶液慢慢倒入水中,发生的变化是。
-
(3) 写出浓硫酸与铜反应的化学方程式:。

已知:①NO与Na2O2可发生反应2NO+Na2O2 =2NaNO2。
②NO、NO  能被酸性高锰酸钾溶液氧化为
能被酸性高锰酸钾溶液氧化为 
③在溶液中存在平衡FeSO4+NO  Fe(NO)SO4(棕色)
Fe(NO)SO4(棕色)
-
(1) I.关闭K3 , 打开K2 , 探究NO与铜粉的反应并检验NO。
反应开始前,打开K1 , 通入一段时间N2 , 其目的是。
-
(2) 装置B中盛放的试剂为水,其作用是。
-
(3) 装置F中的实验现象为。装置H中收集的气体为N2和(填化学式)。
-
(4) Ⅱ.关闭K2 , 打开K3 , 探究NO与Na2O2的反应并制备NaNO2。
装置G的作用是。
-
(5) 若省略装置C,则进入装置G中的气体除N2、NO外,可能还有NO2和(填化学式)。
-
(6) 测定反应后装置E中NaNO2的含量。已知;在酸性条件下,NO
 可将MnO
可将MnO  还原为Mn2+ , 为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
还原为Mn2+ , 为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
①判断滴定终点的方法。
②样品中NaNO2的质量分数为(用含有a、b的代数式表示)。
-
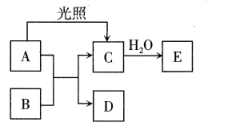
(1) C的化学式是。
-
(2) A与B反应的化学方程式是。
-
(3) A在光照条件下生成C的化学方程式是__,因此应将A保存在__色试剂瓶中。
-
(4) C→E的反应现象是。
-
(1) 氯化亚铜(CuCl)是重要的化工原料,工业上常通过下列反应制备CuCl: 2CuSO4+Na2SO3+2NaCl+Na2CO3=2CuCl↓+3Na2SO4+CO2↑
查阅资料可得,CuCl可以溶解在FeCl3溶液中,请写出该反应的离子方程式。
-
(2) 已知:Cu2O在酸性溶液中发生歧化反应:Cu2O+2H+=Cu2++Cu+H2O。
现将一定量混合物(Fe2O3、Cu2O、CuCl、Fe)溶解于过量稀盐酸中,反应完全后,得到W(包括溶液和少量剩余固体)。
①继续往W中通入足量的氯气,不断搅拌,充分反应,溶液中哪些离子的物质的量一定有明显变化?(用离子符号表示)。
②不通入气体,改往W中加入过量铁粉,过滤,调pH约为7,加入淀粉-KI溶液和H2O2溶液,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是
-
(3) 某工厂废水中含KCN,其浓度为650 mg·L-1 , 现用氯氧化法处理,发生如下反应(化合物中N化合价均为-3) :KCN+2KOH+Cl2=KOCN+2KCl+H2O。
①通入过量氯气,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
_KOCN+_KOH+_ Cl2=_ CO2+_ N2+_KCl+_H2O。
②若将5 m3含KCN的浓度为650 mg·L-1的废水中KCN氧化成N2除去,需要标准状况下的氯气的体积为L。
-
(4) 二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理:2NaClO3+4HCl=2ClO2 ↑+Cl2↑+2H2O+2NaCl。
①该反应中,氧化剂和还原剂的物质的量之比为,依据氧化还原反应规律判断,氧化性强弱为NaClO3 (填“>"<"或“=")Cl2.。
②ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO
 ),需将其转化为Cl-除去,下列试剂中,可将ClO
),需将其转化为Cl-除去,下列试剂中,可将ClO  转化为Cl-的是 (填字母)。
转化为Cl-的是 (填字母)。A.FeSO4 B.O3 C.KMnO4 D.SO2
-
(5) 亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:
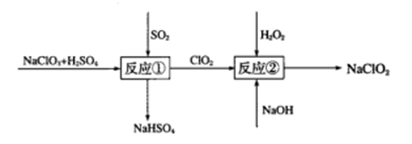
请将流程中反应②的离子方程式补充完整:
_ClO2+_H2O2+_=_ ClO
 + O2+_。
+ O2+_。
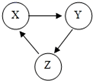
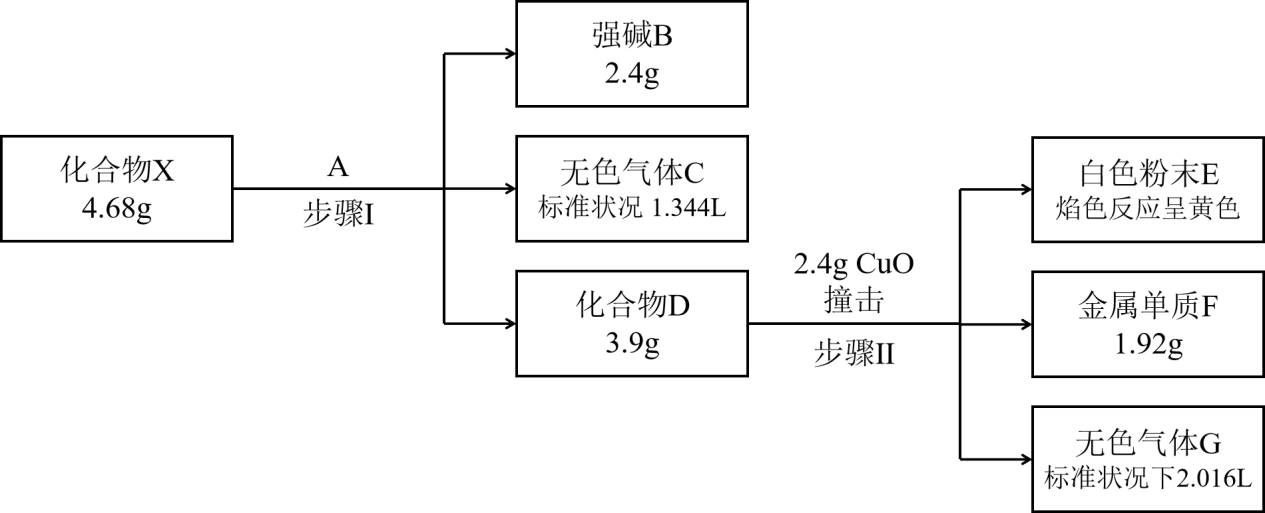 已知:非金属氧化物A的相对分子质量为44;气体C能使湿润的红色石蕊试纸变蓝色;气体G是空气中含量最多的单质。请问答:
已知:非金属氧化物A的相对分子质量为44;气体C能使湿润的红色石蕊试纸变蓝色;气体G是空气中含量最多的单质。请问答:
-
(1) 组成D的非金属元素是(填元素符号),写出C的电子式。
-
(2) 步骤Ⅱ,发生反应的化学方程式是。
-
(3) 工业上制备X是将金属单质与液态C反应得到,写出该反应的化学方程式为。
-
(4) 某同学将擦亮的单质F投入装有足量浓硫酸的大试管中,微热,有黑色和白色的固体析出,但无气体产生(已知,黑色固体由2种元素组成,金属元素质量分数为80%,难溶于水和稀硫酸,可溶于硝酸)。请设计实验验证黑色固体的组成元素。
-
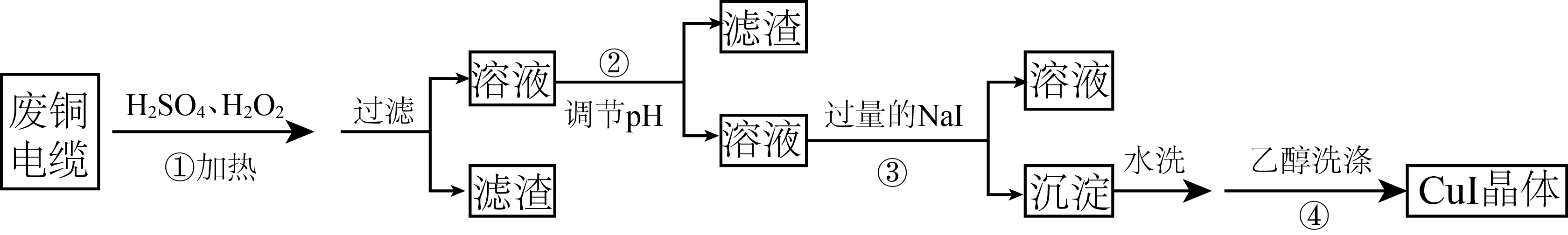
(1) CuI中铜元素的化合价为 , 过程①得到的溶液呈蓝色,其原因是(用化学方程式表示)。
-
(2) 当温度高于40℃时,过程①反应速率减慢,原因是。
-
(3) 过程③需进行的实验操作是。
-
(4) 过程③的氧化产物能使淀粉变蓝,对应的离子方程式为。
-
(5) 过程④用乙醇洗涤沉淀的目的。



