常见金属元素的单质及其化合物的综合应用 知识点题库
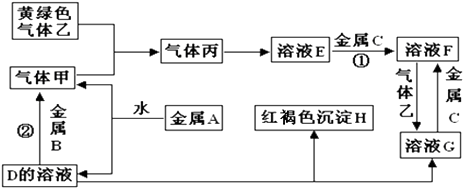
请根据以上信息回答下列问题:
-
(1) 写出下列物质的化学式:
A;H; G;乙;
-
(2) 写出下列反应的化学方程式反应①反应②.
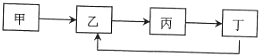
|
选项 |
甲 |
乙 |
丙 |
丁 |
|
A |
S |
SO2 |
SO3 |
H2SO4 |
|
B |
Al |
Al2O3 |
AlCl3 |
Al(OH)3 |
|
C |
Na |
Na2O2 |
Na2CO3 |
NaOH |
|
D |
Si |
SiO2 |
Na2SO3 |
H2SiO3 |
①Si  Na2SiO3(aq)
Na2SiO3(aq)  H2SiO3
H2SiO3
②S  SO3
SO3  H2SO4
H2SO4
③Na  Na2O2 NaOH
Na2O2 NaOH
④饱和NaCl(aq) 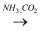 NaHCO3
NaHCO3  Na2CO3
Na2CO3
⑤MgCl2(aq)  MgCl2•6H2O
MgCl2•6H2O  Mg
Mg
⑥Al2O3 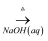 NaAlO2
NaAlO2  Al(OH)3
Al(OH)3
⑦Fe2O3 FeCl3(aq)  无水FeCl3
无水FeCl3
⑧CuSO4(aq)  Cu(OH)2
Cu(OH)2  Cu2O.
Cu2O.
①Al2O3 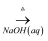 NaAlO2(aq)
NaAlO2(aq)  Al(OH)3
Al(OH)3
②S  SO3
SO3  H2SO4
H2SO4
③饱和NaCl(aq)  NaHCO3
NaHCO3  Na2CO3
Na2CO3
④Fe2O3  FeCl3(aq)
FeCl3(aq)  无水FeCl3
无水FeCl3
⑤MgCl2(aq) 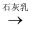 Mg(OH)2
Mg(OH)2  MgO.
MgO.

下列说法正确的是( )
①氧化铝是一种比较好的耐火材料,可用来制造耐火坩埚
②氧化铁常用作红色油漆和涂料
③硅酸钠是制备硅胶和木材防火剂的原料
④用明矾做净水剂除去水中的悬浮物
⑤石灰石、水玻璃、石英和水晶的主要成分都是SiO2 .
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤后溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液产生白色沉淀。
试根据上述实验事实,回答下列问题:
-
(1) 原白色粉末中一定含有的物质是,一定不含的物质是,可能含有的物质是。(以上各种物质均写化学式)
-
(2) 写出下列步骤中发生反应的离子方程式:
①;
②;
③。
|
实验 |
试剂 |
现象 |
|
|
滴管 |
试管 |
||
|
2 mL | 0.2 mol·L−1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
| 0.2 mol·L−1 CuSO4溶液 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
| 0.1 mol·L−1 Al2(SO4) 3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
-
(1) 经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:。
-
(2) 经检验,现象Ⅱ的棕黄色沉淀中不含SO42− , 含有Cu+、Cu2+和SO32−。
已知:Cu+
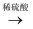 Cu +Cu2+ , Cu2+
Cu +Cu2+ , Cu2+  CuI↓(白色) +I2。
CuI↓(白色) +I2。①用稀硫酸证实沉淀中含有Cu+的实验现象是。
②通过下列实验证实,沉淀中含有Cu2+和SO32−。
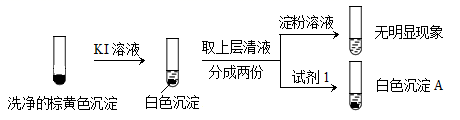
a.白色沉淀A是BaSO4 , 试剂1是。
b.证实沉淀中含有Cu2+和SO32−的理由是。
-
(3) 已知:Al2(SO4) 3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42− , 该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和。
②对于沉淀中亚硫酸根的存在形式提出两种假设:
i.被Al(OH) 3所吸附;
ii.存在于铝的碱式盐中。
对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。
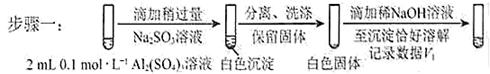
步骤二:(按上图形式呈现) 。
-
(4) 根据实验,亚硫酸盐的性质有。盐溶液间反应的多样性与有关。
实验记录如下:
|
| 实验 | 方案和现象 |
| ⅰ | 加入1mL蒸馏水,再滴加1滴品红溶液,品红溶液较快褪色 | |
| ⅱ | 加入少量Ag2O固体,产生白色沉淀a。再加入1mL蒸馏水和 1滴品红溶液,品红溶液褪色比i快 | |
| ⅲ | 加入1mL较浓AgNO3溶液,产生白色沉淀b。再滴加1滴品红溶液,品红溶液褪色比i慢 |
-
(1) 用离子方程式表示i中品红溶液褪色的原因:。
-
(2) 经检验,ii中的白色沉淀a是AgCl。产生AgCl的化学方程式是。
-
(3) ⅰ是iii的对比实验,目的是排除iii中造成的影响。
-
(4) 研究白色沉淀b的成分。进行实验iv(按实验iii的方案再次得到白色沉淀b,过滤、洗涤,置于试管中):
实验iv:
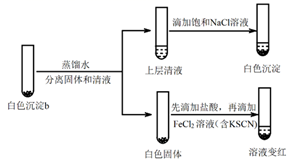
①设计对比实验证实白色沉淀b不只含有AgCl,实验方案和现象是。
②FeCl2溶液的作用是。由此判断,白色沉淀b可能含有AgClO。
-
(5) 进一步研究白色沉淀b和实验iii品红溶液褪色慢的原因,进行实验v:
实验v:
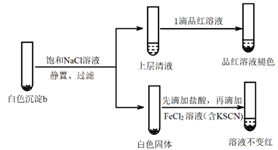
①结合离子方程式解释加入饱和NaCl溶液的目的:。
②推测品红溶液褪色的速率:实验iii比实验v(填“快”或 “慢”)。
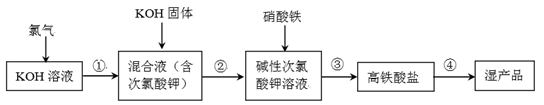
资料:
ⅰ.高铁酸钾可溶于水,微溶于浓KOH溶液,在碱性溶液中较稳定,在酸性或中性溶液中快速产生O2 , 且﹢3价铁能催化该反应。
ⅱ.次氯酸钾容易分解,2KClO=2KCl+O2。
-
(1) 实验室使用高锰酸钾与浓盐酸制备氯气时,应选择下列装置中的。
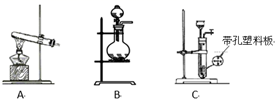
-
(2) 写出步骤①的离子反应方程式 。
-
(3) 加入KOH固体是为了过滤除盐,过滤除去的是。
-
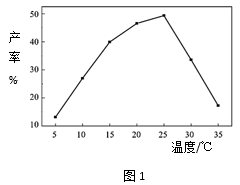
(4) 相同投料比、相同反应时间内,反应温度对高铁酸钾产率的影响如图1所示:
请分析高铁酸钾产率随温度变化的原因: 。
-
(5) 相同投料比、相同反应时间内,硝酸铁浓度对产率的影响如图2所示:
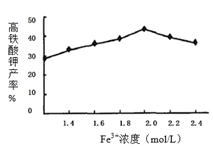
当Fe3+浓度大于2.0mol/L时,高铁酸钾产率变化的原因可能是:。
-
(6) 高铁酸钾可用于除去水体中Mn(+2价),生成Mn(+4价)和Fe(+3价)。一定条件下,除去水体中1.1gMn(+2价),当去除率为90%时,消耗高铁酸钾的物质的量为mol。
| 实验① | 实验② | 实验③ |
| | | |
 、
、  、
、  等离子。利用常用的酸、碱和工业生产中的废铁屑,设计如下工艺流程,从废水中回收金,并生产一定量的铁红和氧化铜。
等离子。利用常用的酸、碱和工业生产中的废铁屑,设计如下工艺流程,从废水中回收金,并生产一定量的铁红和氧化铜。 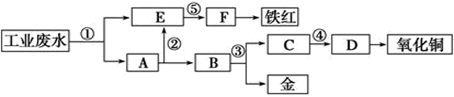
下列说法错误的是( )
 ,工业上常用作红色颜料
,工业上常用作红色颜料
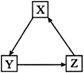
 Y
Y  Z(每步只发生一个反应)所示转化的是( )
Z(每步只发生一个反应)所示转化的是( ) | 选项 | X | Y | Z | M |
| A | Fe | FeCl2 | FeCl3 | Cl2 |
| B | C | CO | CO2 | O2 |
| C | CO2 | Na2CO3 | NaHCO3 | NaOH |
| D | | Al(OH)3 | Al3+ | CO2 |
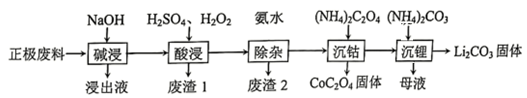
-
(1) “碱浸”步骤中铝溶解的离子方程式为,“废渣1”的主要成分为。
-
(2) LiCoO2中Co的化合价为,“酸浸”步骤中LiCoO2固体溶解的化学方程式为,反应中H2O2的作用为。
-
(3) “酸浸”后的溶液中含有少量Fe3+、Al3+、Cu2+ , 离子的沉淀率随pH的变化如图所示。“除杂”步骤中加入氨水调节溶液的pH约为,理由是。

-
(4) 母液中溶质的主要成分是,生成Li2CO3固体的离子方程式为。
 B . CuCl
C .
B . CuCl
C .  D .
D . 
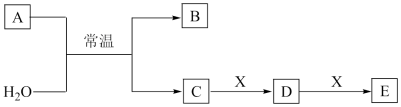
-
(1) 若A的焰色反应为黄色,且A为化合物,回答下列问题:
①A的化学式为,A与H2O反应的离子方程式为。
②若X为具有还原性的非金属单质,通常为黑色粉末,写出E的化学式。
③若X为一种造成温室效应的气体,则鉴别等浓度的D、E两种溶液,可选择的试剂为 (填代号)。
a.NaCl溶液 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
-
(2) 若A为黄绿色气体,具有很强的氧化性,则:
①若C溶液显强酸性,则B发生分解反应的化学方程式为。
②X可能为 (填代号)。
a.NaHCO3 b.Na2CO3 c.Na2SO4 d.Al(OH)3
③请写出A通入NaOH溶液的离子方程式。