无机物的推断 知识点题库
 C
C 
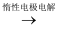 A+B.能实现上述转化关系的是( )
A+B.能实现上述转化关系的是( )①若C溶于水后得到强碱溶液,则A可能是Na
②若C的溶液遇Na2CO3 , 放出CO2气体,则A可能是H2
③若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu.
-
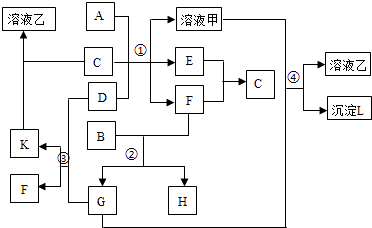
(1) A、B、C、D代表的物质分别为、、、(填化学式);
-
(2) 反应①中的C、D均过量,该反应的化学方程式是;
-
(3) 反应②中,若B与F物质的量之比为4:3,G、H分别是、(填化学式);
-
(4) 反应③产物中K的化学式为;
-
(5) 反应④的离子方程式为.
-
(1) 某同学通过分析,认为无需检验就可判断其中必有的两种物质是和(填化学式,且相对分子质量小的填在前面)
-
(2) 为了确定X,现将(1)中的两种物质记为A和B,含X的物质记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时也产生红褐色沉淀,向该沉淀中滴入稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解.则X为 ;A . SO32﹣ B . SO42﹣ C . CH3COO﹣ D . SiO32﹣
-
(3) B的水溶液不显中性,原因是;
-
(4) 将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4 , Cu逐渐溶解,管口附近有红棕色气体出现,有关反应的离子方程式为;
-
(5) 若把少量E溶液加入A溶液中,无沉淀生成,则该反应的离子方程式为.


回答下列问题:
-
(1) 图B对应的物质名称是,其晶胞中的原子数为,晶体类型为.
-
(2) d中元素的原子核外电子排布式为.
-
(3) 图A中由二种元素组成的物质中,沸点最高的是,原因是,该物质的分子构型为,中心原子的杂化轨道类型为.
-
(4) 图A中的双原子分子中,极性最大的分子是.
-
(5) k的分子式为,中心原子的杂化轨道类型为,属于分子(填“极性”或“非极性”).
I.已知甲和乙为中学常见金属单质,丙和丁为常见气体单质,A~E为常见化合物;A为淡黄色固体,常温下B为液体,C的焰色反应为黄色.试回答下列问题:
-
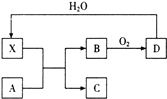
(1) A和 E的化学式分别为、;
-
(2) A+B→C+丙的化学方程式:;
-
(3) D+C→B+E的离子方程式:;
-
(4) 1mol甲和1mol乙混合投入足量的B中,在标准状况下最多能产生L丁气体.
-
(5) II.在标准状况下,取甲、乙、丙各30.mL相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝混合物,得下表中有关数据(反应前后溶液体积不发生变化).
实验序号
甲
乙
丙
混合物质量/mg
255
385
459
气体体积/mL
280
336
336
①甲组实验中,盐酸(填“过量”“适量”或“不足”);乙组实验中,盐酸(填“过量”“适量”或“不足”)
②盐酸的物质的量浓度为mol/L..
③混合物中Mg和Al的物质的量之比为.
 B
B  C
C  D,回答下列问题:
D,回答下列问题:
-
(1) 若A为气态氢化物和D能通过化合反应生成一种盐则
①简述检验该盐中阳离子的方法
②写出实验室制取A的化学方程式
③写出由A生成B的化学方程式
④某同学用干燥的圆底烧瓶收集一瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉.用方程式解释喷泉呈红色的原因
-
(2) 若A与B反应能生成一种淡黄色固体单质写出该反应的化学方程式
-
(3) 若A是金属单质,C是一种淡黄色固体写出C生成D的离子方程式.

请填写下列空白:
-
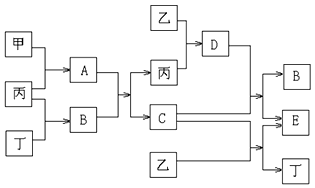
(1) 写出下列物质的化学式:A,G;
-
(2) 若C→D为化合反应,则此时的化学方程式为;
-
(3) 写出E→F的化学方程式:;
-
(4) 写出反应④的离子方程式:.
根据上述实验事实,回答下列问题:
-
(1) 原固体混合物中一定含有的物质是 (填写化学式).对可能含有的物质,可采用向滤液中滴加溶液的方法来检验.
-
(2) 写出步骤③中的离子方程式:.

根据上图和实验现象,回答下列问题:(用化学式表示)
-
(1) A是,B是,C是,X粉末是.
-
(2) 写出反应①的化学方程式.
-
(3) 写出反应②的离子方程式.
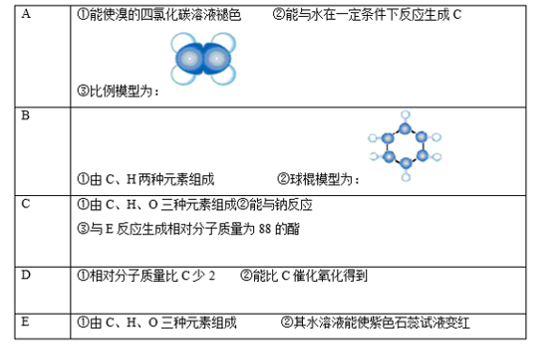
回答下列问题:
-
(1) A~E中,属于烃的是 (填字母)。
-
(2) A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为
-
(3) C和E生成的酯在碱性(氢氧化钠溶液)条件下水解的化学方程式为
-
(4) 有机物B具有的性质是(填序号)。
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
-
(5) E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是 (用化学方程式说明)。

-
(1) 若A是常见的金属单质,D、F是短周期元素的气体单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是;F元素的原子结构示意图为。
-
(2) 若将E 的水溶液蒸干后再灼烧,最后得到的主要固体产物是。
-
(3) D与F可制成新型的化学电源(KOH做电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入气体;负极电极反应式为。用该电池电解1L、1mol/LNaCl溶液,当转移0.1 mol电子时,溶液的pH为 。(不考虑氯气在水中的溶解)
-
(4) 已知1 g D与适量F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式。
|
元素 |
相关信息 |
|
A |
气态氢化物极易溶于水,可用作制冷剂 |
|
B |
单质的焰色反应为黄色 |
|
C |
–2价阴离子的电子层结构与Ar原子相同 |
|
D |
单质是黄绿色气体,可用于自来水消毒 |
请根据表中信息回答:
-
(1) A在周期表中位于第周期族。
-
(2) B的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式为。
-
(3) 研究物质的性质差异性是学习的重要方法之一。A、B、C、D四种元素的最高价氧化物的水化物中,化学性质明显不同于其它三种的是 (填化学式)。
-
(4) 能说明元素D的非金属性强于元素C的非金属性的实验事实是 (填字母)。
a.常温下,两种单质的熔点不同
b.两种元素的气态氢化物的稳定性不同
c.两种元素的最高价氧化物对应的水化物酸性不同
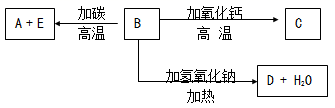
请填空:
-
(1) 形成单质A的原子的结构示意图为,它的最高化合价为。
-
(2) B的化学式为,B和碳反应生成A和E的化学方程式是。
-
(3) C的化学式为,D的化学式(分子式)为。
 其中:A由三种元素组成;气体B(纯净物)是黄绿色气体;溶液C和F均为中性溶液且均只含一种溶质,焰色反应为黄色。
其中:A由三种元素组成;气体B(纯净物)是黄绿色气体;溶液C和F均为中性溶液且均只含一种溶质,焰色反应为黄色。
请回答:
-
(1) 组成A的3种元素是(填元素符号),A的化学式是。
-
(2) 固体A与盐酸反应的化学方程式是。
-
(3) 过量的气体B与氨气反应可得一种黄色液体X(
 ),X与
),X与  中相同元素的化合价也相同,该液体遇水会强烈水解,写出水解的化学方程式。
中相同元素的化合价也相同,该液体遇水会强烈水解,写出水解的化学方程式。
-
(4) 将气体B与
 同时通入足量水中发生氧化还原反应,离子方程式为。设计实验证明该反应为不可逆反应。
同时通入足量水中发生氧化还原反应,离子方程式为。设计实验证明该反应为不可逆反应。
 下列判断错误的是( )
下列判断错误的是( )

-
(1) 下列事实不能证明元素F的非金属性弱于元素D的是(填标号)。
a.D和F的最简单氢化物的稳定性:F
b.常温下F的单质呈固态,D的单质呈气态;
c.D与F形成的化合物中,F显正价
d.D和F的单质氧化性:F
-
(2) 写出M与甲的浓溶液加热时反应的化学方程式;
-
(3) X、Y、Z、W属于同一类物质,X、Y、W都能与Z反应,4种化合物中沸点最高的是(填化学式);
-
(4) 化合物ED2与M在高温下能发生置换反应,若反应中有1mol电子发生转移,则参加反应的化合物ED2的质量为g;
-
(5) 元素C能分别与元素A和D均按原子个数比1:2形成化合物丙和丁,丙的结构式为;常温下,液体丙与气体丁反应生成两种无污染的物质,该反应的氧化产物与还原产物的物质的量之比为。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、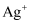 中的某一种。现做以下实验:①将四种盐各取少量,分别溶于盛有6mL蒸馏水的四支试管中,只有B盐溶液呈黄色。②分别向4支试管中加入1mL稀盐酸,发现A盐溶液中产生白色沉淀、C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
中的某一种。现做以下实验:①将四种盐各取少量,分别溶于盛有6mL蒸馏水的四支试管中,只有B盐溶液呈黄色。②分别向4支试管中加入1mL稀盐酸,发现A盐溶液中产生白色沉淀、C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
-
(1) 根据上述事实,写出化学式:ABCD。
-
(2) 写出下列反应的离子方程式:
①A+D→:
②C+HCl→气体:
-
(3) 检验钾盐与钡盐可以通过做来区别,透过蓝色钴玻璃看,呈现色火焰的是钾盐



