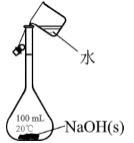
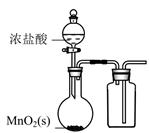
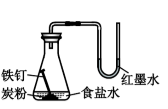
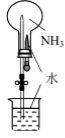
氯气的实验室制法 知识点
氯气的实验室制法 知识点题库
请回答下列问题:
-
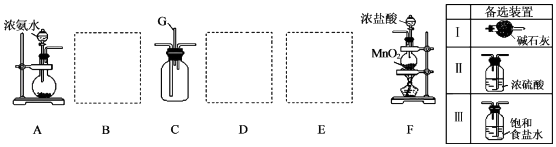
(1) 装置F中发生反应的离子方程式为.
-
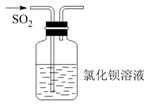
(2) 甲、乙两同学分别采用下列两种方案制取Cl2:甲:用含HCl 146g的浓盐酸与足量的MnO2反应.乙:用87g MnO2与足量浓盐酸反应.则所得氯气(填字母).
a.甲比乙多b.乙比甲多c.一样多
-
(3) 仪器H的名称是(填名称),装置E的作用是.
-
(4) 装置C的导管G处逸出的尾气中可能含有黄绿色的有毒气体,可用进行尾气处理(填选用试剂的名称).
请回答下列问题:
-
(1) 装置F中发生反应的离子方程式为.
-
(2) 装置A中的烧瓶内固体可选用 (填字母).A . 碱石灰 B . 生石灰 C . 二氧化硅 D . 五氧化二磷
-
(3) 虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B,D,E.
-
(4) 催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质.写出该反应的化学方程式:;该反应中每生成0.5mol N2转移 mol电子.
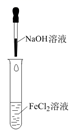
| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C. | 浓盐酸 | 二氧化锰 | 产生黄绿色气体 |
| D. | 新制氯水 | 淀粉—碘化钾溶液 | 溶液变蓝色 |
-
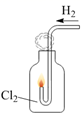
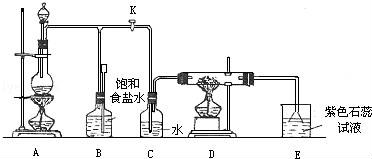
(1) A是氯气发生装置,其中反应的化学方程式为.
-
(2) 实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:;装置C的作用是 。
-
(3) 在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是。
-
(4) 若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为。(选填标号)
(A)有白色沉淀生成(B)无明显变化(C)先生成白色沉淀,而后白色沉淀消失
-
(5) D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是,B的作用是。
回答下列问题:
-
(1) 装置A中发生反应的离子方程式为。
-
(2) 装置B中的作用是,装置E的作用是。
-
(3) 装置D中发生反应的化学方程式为。
-
(4) 装置F的作用是,可以用一个盛装(填试剂名称)的干燥管代替装置F和G,使实验更简便。
| | | | |
| A.配制一定物质的量浓度的NaOH溶液 | B.实验室制取Cl2 | C.验证铁的析氢腐蚀 | D.验证氨气易溶于水 |
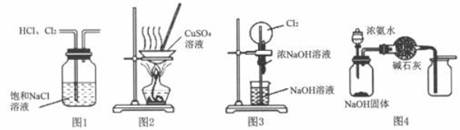

-
(1) 写出A中制取氯气的化学方程式。
-
(2) B装置的作用是。
-
(3) 实验时C中可观察到的现象是。
-
(4) D瓶盛放的试剂是。
-
(5) E中发生反应的化学方程式是。
-
(6) F瓶溶液的作用是,写出发出反应的离子方程式。
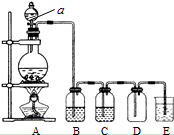
-
(1) A装置中发生反应的化学方程式是,其中氧化剂是,每生成1 mol Cl2 , 被氧化的物质的物质的量是mol,电子转移mol。
-
(2) 仪器a的名称是。
-
(3) B装置中所盛的试剂是,装置C的作用是。
-
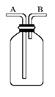
(4) 若将下图集气瓶中充满饱和食盐水,代替装置D收集氯气,此时应气体从口流入(填“A”或“B”)。
-
(5) E装置中发生反应的化学方程式是。
-
(6) 将下图装置代替装置D和E,可进行“氯气与金属钠反应”的实验,以下叙述正确的是________。
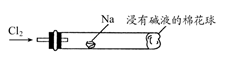 A . 反应生成的大量白烟是氯化钠晶体 B . 玻璃管尾部塞一团浸有碱液的棉球是用于吸收过量的氯气,以免其污染空气 C . 玻璃管中,钠燃烧时会产生苍白色火焰 D . 若在棉球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收
A . 反应生成的大量白烟是氯化钠晶体 B . 玻璃管尾部塞一团浸有碱液的棉球是用于吸收过量的氯气,以免其污染空气 C . 玻璃管中,钠燃烧时会产生苍白色火焰 D . 若在棉球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收
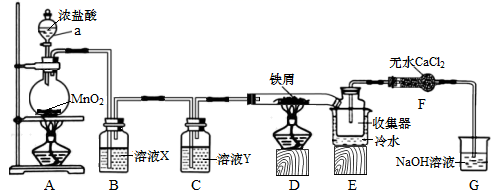
回答下列问题:
-
(1) 仪器a的名称是,装置A发生反应的化学方程式为。
-
(2) 溶液X、Y依次是、;装置D发生反应的化学方程式为。
-
(3) 实验结束时,应先熄灭(填“A”或“D”)处酒精灯;E中冷水的作用是。
-
(4) 装置F的作用是;装置G发生反应的离子方程式。
-
(1) I.舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一,回答下列问题:
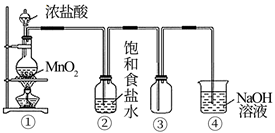
装置①中制取氯气,实验室用二氧化锰和浓盐酸制备氯气的化学方程式为.
-
(2) 装置②中的饱和食盐水的作用.
-
(3) II.贝托莱发现氯气能溶于水.
某兴趣小组进行了如下实验:向含有酚酞的
 溶液滴加氯水,当氯水滴到一定量时,红色溶液会褪去.推测产生这现象的原因有二:①是氯气与氢氧化钠溶液反应后,溶液不显碱性,使酚酞由红色变成无色;②是.请设计实验证明红色褪去的原因是①或②:.
溶液滴加氯水,当氯水滴到一定量时,红色溶液会褪去.推测产生这现象的原因有二:①是氯气与氢氧化钠溶液反应后,溶液不显碱性,使酚酞由红色变成无色;②是.请设计实验证明红色褪去的原因是①或②:.
-
(4) 同学们利用数字化实验探究氯水失效的原因,进行如下实验:用强光照射盛有新制氯水的密闭广口瓶,并用传感器测定广口瓶中氢离子浓度和广口瓶中氧气的体积分数,得到如下曲线.

解释上两图中曲线变化的原因(用化学方程式表示).
若在上述整个实验过程中测定溶液
 的变化是(填“增大”、“减小”或“不变”).
的变化是(填“增大”、“减小”或“不变”).
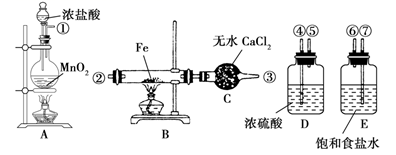
-
(1) 按照气体流向从左到右的顺序连接仪器(填仪器接口):
①接,接,接②。
-
(2) A装置的烧瓶中发生反应的离子方程式为,B装置中发生反应的化学方程式为。
-
(3) D装置的作用是;E装置的作用是。
-
(4) 实验开始时,应先点燃(填“A”或“B”)处的酒精灯。
-
(5) 工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为,已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)= CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是 (填序号)。①CO2②HCl ③H2O ④H2
A.①②③ B.②③④ C.②③ D.①④
| | | | |
| A.将浓盐酸滴入后产生黄绿色气体 | B.少量SO2通入氯化钡溶液,产生白色沉淀 | C.出现苍白色火焰,集气瓶口有白雾 | D.试管中产生白色沉淀,较长时间不变色 |
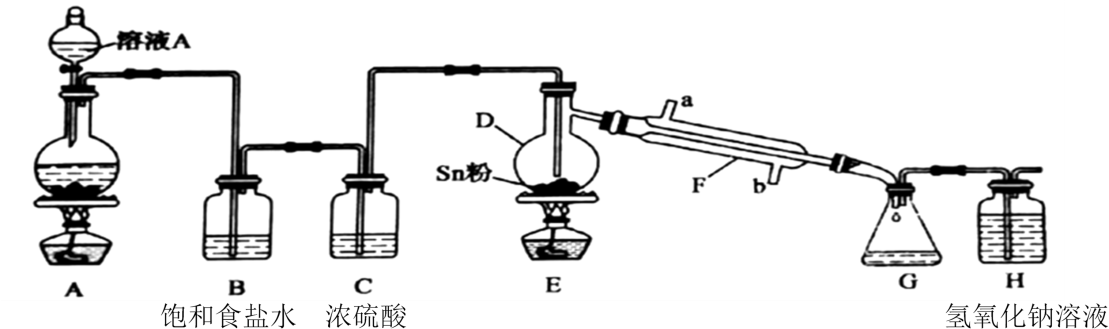
已知:①金属锡熔点为231℃,化学活泼性与铁相似。
②SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解生成SnO2·xH2O,在潮湿的空气中发烟。
③SnCl2中的Sn2+易被氧化为Sn4+。
回答下列问题:
-
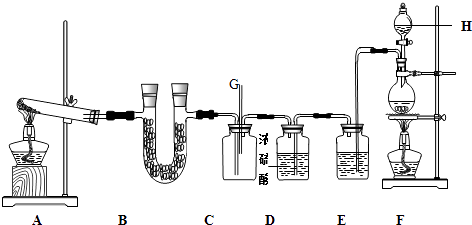
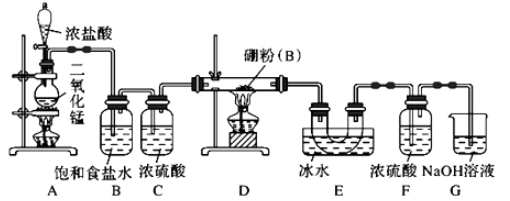
(1) 打开分液漏斗上端活塞的作用是,装置A中发生反应的化学方程式为。
-
(2) 实验开始时,正确的操作顺序为(用下列序号排顺序)。
①点燃装置A处酒精灯②点燃装置D处酒精灯③打开分液漏斗活塞
-
(3) 装置B中试剂的作用是,装置F中冷凝水的方向是从端进(填“a”或“b”)。
-
(4) 若没有装置C(其他均相同),则D中发生的主要副反应的化学方程式为:。
-
(5) 该实验装置存在设计缺陷,你的改进措施为。
-
(6) H为尾气处理,请写出反应的离子方程式。
资料:①锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3  +2H2O=2
+2H2O=2  +MnO2↓+4OH-
+MnO2↓+4OH-
②酸性条件下的氧化性:KMnO4>KIO3>I2
-
(1) I.KMnO4的制备
从A~D中选择合适的装置制备KMnO4 , 正确的连接顺序是a→(按气流方向,用小写字母表示);装置A中m的作用是。
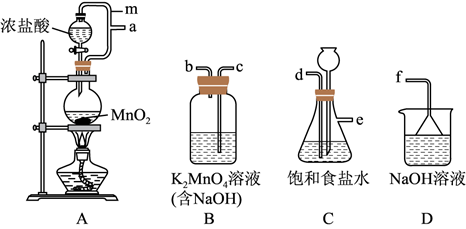
-
(2) 若没有使用装置C,造成的影响是。
-
(3) II.KMnO4性质探究
取适量制取的KMnO4溶液稀释至约0.01mol/L(用硫酸酸化至pH=1),取配制好的KMnO4溶液2mL于试管中,逐滴滴加0.1mol/LKI溶液,KMnO4紫色溶液迅速变为棕褐色悬浊液,然后沉淀逐渐消失,最终溶液变为棕黄色。
最终溶液呈现踪黄色推测生成了(写化学式)。
-
(4) 实验小组对初始阶段的产物成分进行探究:
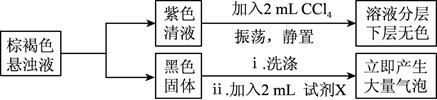
①黑色固体是MnO2 , 试剂X是(写化学式)。
②在“紫色清液"中存在
 ,写出生成
,写出生成  的离子方程式。
的离子方程式。③下列实验方案中,可用于检验“紫色清液"中是否存在
 的是(填序号)。
的是(填序号)。A.用洁净的玻璃棒随取紫色清液滴在淀粉-KI试纸上,观察试纸是否变蓝色。
B.取少量紫色清液于试管中,向其中加入几滴淀粉溶液,溶液不变蓝,再加入过量NaHSO3溶液,观察溶液是否变色。
C.取少量紫色清液于试管中,向其中加入稀硝酸酸化,再加入几滴硝酸银溶液,观察是否生成黄色沉淀。
-
(5) 探究实验II中棕褐色沉淀消失的原因:
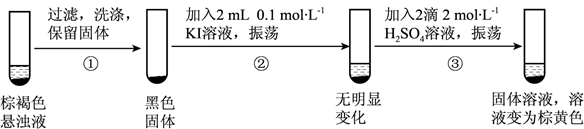
用离子方程式解释步骤③中固体消失的原因。
-
(6) 由上述实验可知,KMnO4的还原产物与有关。
-
(1) Ⅰ.某化学兴趣小组用如图装置制备家用消毒液。
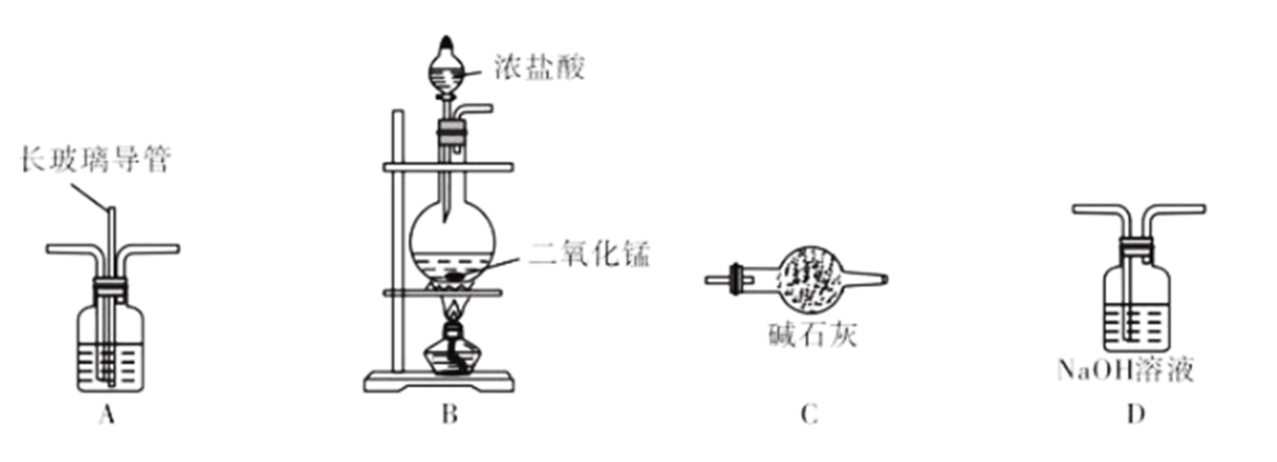
写出装置B中反应的离子方程式。
-
(2) 装置A中的溶液是,长玻璃导管的作用是。图中装置的连接顺序是B、。
-
(3) 用化学方程式表示装置D中“84消毒液的生成过程:。
-
(4) 某温度下,将氯气通入
 溶液中,得到
溶液中,得到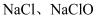 和
和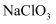 的混合溶液,经测定
的混合溶液,经测定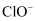 与
与 的物质的量之比为
的物质的量之比为 。则该反应中,被氧化的
。则该反应中,被氧化的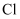 与被还原的
与被还原的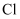 的质量之比为。
的质量之比为。
-
(5) Ⅱ.世卫组织将其定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。
消毒效率是用单位质量的消毒剂得电子数来表示的,
 作消毒剂时和
作消毒剂时和 一样,还原产物均为
一样,还原产物均为 。
。 的消毒效率是
的消毒效率是 的倍(保留两位小数)。
的倍(保留两位小数)。
-
(1) I.制备[(CNO)3Cl2H] 二氯异氰尿酸装置如图。

主要反应有:
碱溶: (CNO)3H3+2NaOH=(CNO)3Na2H+2H2O △H <0
氯化: (CNO)3Na2H+2Cl2
 (CNO)3Cl2H+2NaCl △H <0
(CNO)3Cl2H+2NaCl △H <0图中仪器a的名称为。
-
(2) 写出装置A中反应的离子方程式。
-
(3) 装置B用冰水浴的原因可能是。
-
(4) 装置C中的溶液是, 其作用是。
-
(5) 碱溶时若NaOH过量,(CNO)3Na2H中可能混有的杂质是。
-
(6) II.制备(CNO)3Cl2Na
将B装置中制得的(CNO)3Cl2H与NaOH溶液按物质的量比1:1进行中和,写出中和反应的化学方程式, 反应完成后冷却结晶、过滤、干燥得到(CNO)3Cl2Na。
-
(7) 通过实验测定二氯异氰尿酸钠样品中(不含NaClO)有效氯含量的反应原理为:
[(CNO)3Cl2]-+H++2H2O=(CNO)3H3+2HClO
HClO+2I-+H+=I2+Cl-+H2O
I2+2
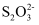 =
=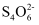 +2I-
+2I-实验步骤:准确称取wg样品配成100mL溶液,取25.00mL于碘量瓶中,加入适量稀硫酸和过量KI溶液,暗处静置充分反应后,用0.1000 mol·L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液VmL。
①滴定终点的现象是。
②该样品中有效氯含量的表达式为
(有效氯=
 )。
)。
-
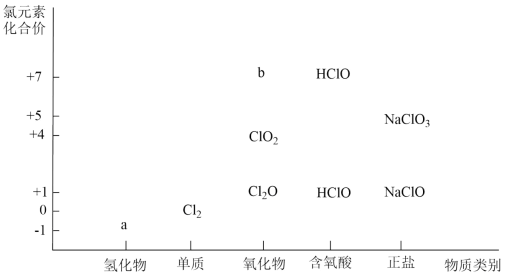
(1) a物质的化学式为,b属于 (填“酸性”或“碱性”)氧化物。
-
(2) 用ClO2消毒水时,ClO2还可将水中的Fe2+转化为Fe3+ , Fe3+再水解生成Fe(OH)3胶体,说明ClO2具有性,检验有胶体生成的简便方法是。
-
(3) 工业上可以用反应2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4 , 制备ClO2 , 若生成1molClO2 , 则反应中转移电子的物质的量为。
-
(4) 实验室可用二氧化锰与浓盐酸在加热条件下制取氯气,写出该反应的化学方程式:。
①浓盐酸在该反应中体现的性质有 (填字母)。
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.2molCl2 , 需消耗MnO2的质量为 g。