过氧化氢 知识点
过氧化氢:是除水外的另一种氢的氧化物,粘性比水稍高,化学性质不稳定。纯过氧化氢是淡蓝色的黏稠液体,可任意比例与水混溶,是一种强氧化剂。其一般以30%或60%的水溶液形式存放,俗称双氧水,为无色透明液体,适用于医用伤口消毒、环境消毒和食品消毒,但过氧化氢也是世界卫生组织公布的致癌物。
过氧化氢 知识点题库
以下涉及H2O2的反应(未配平)中,H2O2仅表现出氧化性的是( )
A . Ag2O+H2O2═Ag+O2↑+H2O
B . H2O2═ H2O+O2↑
C . H2O2+Cr2(SO4)3+KOH═K2CrO4+K2SO4+H2O
D . Na2O2+HCl═H2O2+NaCl
下列物质均能使某些有色物质褪色,但褪色原理不同于其它3个的是( )
A . H2O2
B . HClO
C . Cl2
D . SO2
前中国科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成化合物H2NCONH2•H2O2 , 不但使H2O2稳定下来,而且其结构也没有发生改变,得到了可供衍射实验的单晶体.已知H2O2的结构式为H﹣O﹣O﹣H,下列说法中不正确的是( )
A . H2NCONH2与H2O2是通过氢键结合的
B . H2O2分子中只含σ键,不含π键
C . H2O2既有氧化性又有还原性
D . H2NCONH2•H2O2属于离子化合物
过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3•3H2O2 , 它具有Na2CO3和H2O2的双重性质.过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是( )
A . MnO2
B . KMnO4溶液
C . 稀盐酸
D . Na2SO3溶液
在渔业生产中,有时需要异地运输鱼苗,为保证运输过程中鱼苗不死亡,必须满足下列条件:(1)水的pH要调在8~8.5之间;(2)防止细菌大量繁殖;(3)水中要溶有充足的氧气;(4)使鱼苗呼出的CO2气体及时排出.在长距离储运鱼苗的水中,最好加入下列物质中的( )
A . 纯净的氧气
B . 过氧化氢
C . 过氧化钠
D . 过氧化钙
将3.2g Cu投入100mL稀硫酸中加热,没有明显变化,若边加热边缓缓加入一定量H2O2 , 金属Cu逐渐溶解,则下列说法正确的是( )
A . 反应过程中有刺激性气味的气体生成
B . H2O2对Cu和稀硫酸的反应起催化作用
C . 若Cu和硫酸恰好完全反应,则稀硫酸的物质的量浓度为0.5mol/L
D . 反应中硫酸既表现出酸性有表现出氧化性
工业上最早在19世纪中叶便已生产的过氧化氢,目前已经成为社会需求量迅速增长的化学品.原因是它在使用时,很少产生污染.在过氧化氢分子中,一个过氧键:﹣O﹣O﹣(短线表示一对共用电子对),每个氧原子各连着1个氢原子.纯的过氧化氢是蓝色粘稠液体,沸点152.1℃,冰点﹣0.89℃.
(1)写出过氧化氢的化学式 .
(2)过氧化氢是 化合物(填离子或共价).
(3)写出过氧化氢分子的电子式:
(4)过氧化氢分子中氧元素的化合价是
下列有关说法错误的是( )
A . H2O2、Na2O2都属于过氧化物、都存在非极性共价键
B . H2O2做漂白剂是利用其强氧化性,漂白原理与HClO类似但与SO2不同
C . 双氧水是绿色氧化剂,可作医疗消毒剂
D . H2O2既有氧化性又有还原性,1molH2O2在参加反应时一定转移2mol电子
用纯碱和双氧水混合可制作新型液体洗涤剂(2Na2CO3•3H2O2),它具有杀菌消毒去油污的能力且不会污染水源.
-
(1) 写出H2O2的电子式.
-
(2) 这种洗涤剂中的双氧水可以将废水中的氰化钠(NaCN)转化为无毒物同时生成NH3 , 写出反应的离子方程式:.
-
(3) 如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用.试分析其中的原因(结合文字表述和离子方程式说明):.
下列有关物质的性质或应用正确的是( )
A . 单质硅用于制造芯片和光导纤维
B . 浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性
C . SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色
D . 30%的H2O2溶液中加入MnO2可制得O2 , MnO2做氧化剂
下列说法正确的是( )
A .  在空气中加热可得固体
在空气中加热可得固体  B .
B .  加入到过量
加入到过量  溶液中可得
溶液中可得  C .
C .  在沸腾炉中与
在沸腾炉中与  反应主要生成
反应主要生成  D .
D .  溶液中加入少量
溶液中加入少量  粉末生成
粉末生成  和
和 
 在空气中加热可得固体
在空气中加热可得固体  B .
B .  加入到过量
加入到过量  溶液中可得
溶液中可得  C .
C .  在沸腾炉中与
在沸腾炉中与  反应主要生成
反应主要生成  D .
D .  溶液中加入少量
溶液中加入少量  粉末生成
粉末生成  和
和 
下列说法正确的是( )
A . Na2O的热稳定性大于Na2O2
B . Mg加入到过量FeCl3溶液中可得Fe
C . 亚硝酸钠与硝酸银溶液反应生成不溶于稀硝酸的沉淀
D . H2O2溶液中加入少量CuO粉末可加快生成H2O和O2
物质的应用性是化学科学研究的重要内容。下列物质的性质与用途具有对应关系的是( )
A . FeCl3水溶液显弱酸性,可用作H2S的脱除剂
B . SO2具有漂白性,可用于制溴工业中吸收Br2
C . NaN3分解产生大量气体,可用作汽车安全气囊产气药
D . H2O2能使蛋白质变性,可用作供氧剂
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某化学探究小组将一批废弃的线路板简单处理后,得到Cu、A、Fe及少量Au等金属的混合物,并设计出如图制备硫酸铜和硫酸铝晶体的路线:
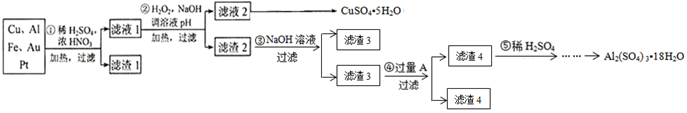
已知:②中加入H2O2的目的是将Fe2+氧化为Fe3+。回答下列问题:
-
(1) ①中Cu与稀硝酸反应的离子方程式为 ;
-
(2) 滤渣2的主要成分为 、 。
-
(3) 滤液3中Al元素的存在形式为 (填化学式)。
-
(4) ④中A物质为 。
-
(5) 金属铝与氧化铁在高温下会发生剧烈反应,产生固体熔融物。该反应的化学方程式为 ,设计实验证明得到的熔融物中含有金属铝 。
防控新冠肺炎疫情经常会用到各类消毒剂,下列对各类消毒剂的说法错误的是( )
A . 84消毒液的有效成分是NaClO,NaClO是离子化合物
B . 75%酒精中乙醇的体积分数大于水的体积分数,乙醇是溶剂
C . H2O2中存在两种共价键
D . Cl2O所含元素的原子半径:Cl>O
下列有关实验操作的说法正确的是( )
A . 简易量热计中的环形玻璃搅拌棒可以用环形的铜棒来代替,搅拌效果相同
B . 用 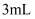 95%的乙醇溶解2~3粒
95%的乙醇溶解2~3粒  晶体,溶液呈蓝色
C . H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快
D . 用NaOH溶液滴定CH3COOH时,应选用甲基橙为指示剂
晶体,溶液呈蓝色
C . H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快
D . 用NaOH溶液滴定CH3COOH时,应选用甲基橙为指示剂
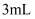 95%的乙醇溶解2~3粒
95%的乙醇溶解2~3粒  晶体,溶液呈蓝色
C . H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快
D . 用NaOH溶液滴定CH3COOH时,应选用甲基橙为指示剂
晶体,溶液呈蓝色
C . H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快
D . 用NaOH溶液滴定CH3COOH时,应选用甲基橙为指示剂
下列反应可以应用于工业生产的是( )
A . 氯气与石灰乳反应生产漂白粉
B . 钠在氯气中燃烧生产食盐
C . 双氧水和二氧化锰共热制取氧气
D . 用氯碱工业所得氢气和氯气制取盐酸
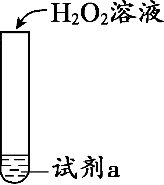
探究H2O2溶液的性质,根据实验所得结论不正确的是( )
实验 | 试剂a | 现象 | 结论 | |
A |
| 溶有SO2的BaCl2溶液 | 产生沉淀 | H2O2有氧化性 |
B | 酸性KMnO4溶液 | 紫色溶液褪色 | H2O2有氧化性 | |
C | KI淀粉溶液 | 溶液变蓝 | H2O2有氧化性 | |
D | 盐酸酸化的FeCl2溶液 | 溶液变黄 | H2O2有氧化性 |
A . A
B . B
C . C
D . D
H2O2的水溶液俗称双氧水,广泛用于污水处理、化学制药、纺织等领域。
已知:①过量的H2O2可以与SCN-反应。
②酸性溶液中,KMnO4能被H2O2还原为Mn2+。
③Mn2+可以加快H2O2分解。
-
(1) H2O2分子中含有的化学键有____(填序号)。A . 离子键 B . 极性共价键 C . 非极性共价键
-
(2) 预测H2O2具有氧化性和还原性,从元素化合价角度说明其具有还原性的预测依据:。
-
(3) 检验H2O2的氧化性
实验步骤
实验现象
步骤1:取1mL0.01mol/LFeCl2溶液(pH=1)于试管内,滴入3滴0.01mol/LKSCN溶液
无明显变化
步骤2:向试管内滴入2滴amol/LH2O2溶液
溶液变为血红色
步骤3:向试管内再滴入2滴amol/LH2O2溶液
红色褪去
①步骤2发生反应的离子方程式是、Fe3++3SCN-⇌ Fe(SCN)3。
②用平衡移动原理解释步骤3中红色褪去的原因:。
-
(4) 检验H2O2的还原性
18O可用来标记示踪。取过量的酸性KMnO4溶液于试管内,加入bmL浓度为amol/LH218O2溶液,持续收集产生的气体,待气体体积不再增加,测定干燥后的气体质量。
已知KMnO4的还原产物是Mn2+。理论上所得气体的质量为g(用含a、b的计算式表示)。实际所得气体质量小于理论值,且在水中也能找到18O,原因是:。
下列“类比”推测不合理的是( )
A . Na2S2与盐酸反应生成NaCl、S和H2S,则S2Cl2在盐酸中转化为HCl、S和H2S
B . Na2O2具有较强的氧化性,则Na2S2也具有氧化性,但比Na2O2弱
C . H2O2易分解为H2O和O2 , 则H2S2也易分解为H2S和S
D . H2O2的分子构型不是直线形,则S2Cl2也不是直线形
最近更新