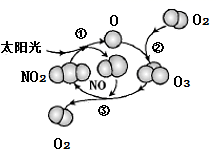
探究二氧化氮与水的反应 知识点题库
 B .
B .  C .
C .  D .
D . 
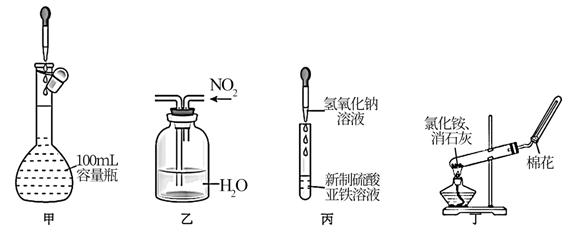
 制取NO2
B .
制取NO2
B . 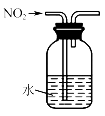 净化NO2
C .
净化NO2
C .  收集NO2
D .
收集NO2
D . 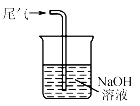 尾气处理
尾气处理
A | B | C | D |
检验装置气密性 | 氨气尾气处理 | NO2被水完全吸收 | 比较NaHCO3和Na2CO3溶解度 |
|
|
|
|
① CO、O2 ② Cl2、CH4 ③ NO2、O2④ N2、H2
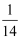 mol·L-1
B .
mol·L-1
B . 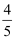 mol·L-1
C .
mol·L-1
C . 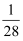 mol·L-1
D .
mol·L-1
D . 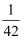 mol·L-1
mol·L-1
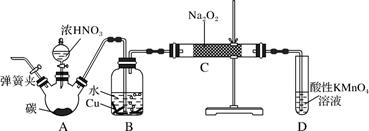
查阅资料:
①HNO2为弱酸,室温下存在反应:3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成;
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
-
(1) B中观察到的主要现象是,D装置的作用是。
-
(2) 经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。生成碳酸钠的化学方程式是。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是 (写名称)。
-
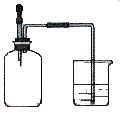
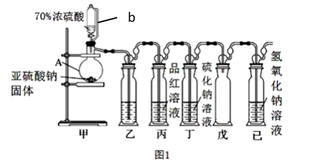
(1) Ⅰ.某研究小组设计了一套制备及检验 SO2 部分性质的装置,如图 1 所示。
仪器 A 的名称,导管 b 的作用。
-
(2) 装置乙的作用是为了观察生成 SO2的速率,则装置乙中加入的试剂是。
-
(3) ①实验前有同学提出质疑:该装置没有排空气,而空气中的 O2 氧化性强于 SO2 , 因此 装置丁中即使有浑浊现象也不能说明是 SO2 导致的。请你写出 O2 与 Na2S 溶液反应的化学 反应方程式。
②为进一步检验装置丁产生浑浊现象的原因,进行新的实验探究。实验操作及现象见表。
序号
实验操作
实验现象
1
向 10ml 1mol·L-1 的 Na2S 溶液中通 O2
15min 后,溶液才出现浑浊
2
向 10ml 1mol·L-1 的 Na2S 溶液中通 SO2
溶液立即出现黄色浑浊
由实验现象可知:该实验条件下 Na2S 溶液出现浑浊现象是 SO2 导致的。你认为上表实验 1 反应较慢的原因可能是。
-
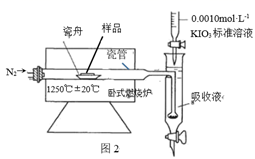
(4) Ⅱ.铁矿石中硫元素的测定可以使用燃烧碘量法,其原理是在高温下将样品中的硫元素转化 为 SO2 , 以 淀 粉 和 碘 化 钾 的 酸 性 混 合 溶 液 为 SO2 吸 收 液 , 在 SO2 吸 收 的 同 时 用 0.0010mol·L-1KIO3 标准溶液进行滴定,检测装置如图 2 所示:
[查阅资料] ①实验进行 5min,样品中的 S 元素都可转化为 SO2
②2IO3-+5SO2+4H2O=8H++5SO42-+I2
③I2+SO2+2H2=2I-+SO42-+4H+
④IO3-+5I-+6H+=3I2+3H2O
工业设定的滴定终点现象是。
-
(5) 实验一:空白试验,不放样品进行实验,5min 后测得消耗标准液体积为 V1mL
实验二:加入 1g 样品再进行实验,5min 后测得消耗标准液体积为 V2mL
比较数据发现 V1 远远小于 V2 , 可忽略不计 V1。 测得 V2 的体积如表
序号
1
2
3
KIO3 标准溶液体积/mL
10.02
9.98
10.00
该份铁矿石样品中硫元素的质量百分含量为。
3NO2+H2O=2HNO3+NO (第一次吸收)
但这一步NO2的吸收率只有2/3,还余下1/3的NO。为了更多地吸收NO2 , 工业上通常把生成的NO再次氧化为NO2 , 再次用水吸收
2NO+O2=2NO2 (第一次通O2)
3NO2+H2O=2HNO3+NO (第二次吸收)
如此循环,可以使NO2全部转化为HNO3 。
现有3升NO2 , 如果按上述方法进行循环氧化吸收:
-
(1) 则第二次吸收后,NO2的总吸收百分率为(可以用分数表示,下同),第二次通入O2的体积为升,第三次吸收后还剩余NO升。
-
(2) 第n次吸收后剩余NO的体积为升(用含n的代数式表示)。
-
(3) 如果要使3升NO2恰好完全转化为HNO3 , 则需通入O2的总体积为升。
(所有气体体积均在相同条件下测定)

回答下列问题:
-
(1) 在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是。
-
(2) 在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式:。
-
(3) 实验室中,检验溶液中含有NH4+ 的操作方法是。
-
(4) 物质B为红棕色气体,写出该物质与水反应的离子方程式: ,当反应消耗0.15 mol物质B时,转移电子的物质的量为。
 为阿伏加德罗常数的值。下列叙述正确的是( )
为阿伏加德罗常数的值。下列叙述正确的是( )
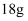 重水(
重水(  )中含有的质子数为
)中含有的质子数为  B .
B . 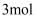 的
的  与
与  完全反应时转移的电子数为
完全反应时转移的电子数为  C .
C . 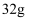 环状
环状  (
( 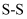 键数为
键数为  D .
D . 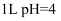 的
的 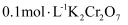 溶液中
溶液中  离子数为
离子数为 
 C . 丙:制备
C . 丙:制备 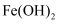 D . 丁:制备氨气
D . 丁:制备氨气
 中混有少量水蒸气:通过装有浓硫酸的洗气瓶
B .
中混有少量水蒸气:通过装有浓硫酸的洗气瓶
B . 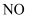 中混有少量
中混有少量  气体:用水洗涤后再干燥
C . 食盐中混有少量
气体:用水洗涤后再干燥
C . 食盐中混有少量  :加过量烧碱溶液后加热蒸干
D . 硝酸混有少量硫酸:加适量
:加过量烧碱溶液后加热蒸干
D . 硝酸混有少量硫酸:加适量  后再过滤
后再过滤