工业合成氨 知识点
工业合成氨 知识点题库
[Cu(NH3)2Ac]+CO+NH3 [Cu(NH3)3]Ac·CO+Q
[Cu(NH3)3]Ac·CO+Q
-
(1) 必须除去原料气中CO的原因是?
-
(2) 醋酸二氨合铜(l)吸收CO的适宜条件是。
-
(3) 吸收CO后的醋酸铜氨液经过适当处理又可再生,恢复其吸收CO的能力以循环使用,醋酸铜氨液再生的适宜条件是。
A.氨水 B.硫化氢气体
C.硫酸钠溶液 D.纯碱溶液
Ⅱ合成氨的流程示意图如下:
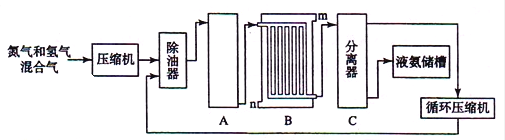
回答下列问题:
(1)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 ,
(2)设备A中含有电加热器、触煤和热交换器,设备A的名称 , 其中发生的化学反应方程式为 ;
(3)设备B的名称 ,其中m和n是两个通水口,入水口是 (填“m”或“n”).不宜从相反方向通水的原因 ;
(4)设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
CO(g)+H2O(g)⇌CO2 (g)+H2 (g)
已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 .
![]()
下列关于合成氨反应的叙述中错误的是( )
-
(1) (一)合成氨工艺(流程如图所示)是人工固氮最重要的途径。
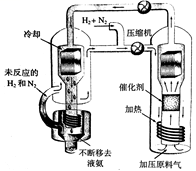
2018年是合成氨工业先驱哈伯(P•Haber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g)
 NH3(g) △H(298K)= - 46.2KJ•mol-1 , 在Fe催化剂作用下的反应历程为(*表示吸附态)
NH3(g) △H(298K)= - 46.2KJ•mol-1 , 在Fe催化剂作用下的反应历程为(*表示吸附态)化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*
 NH*;NH*+ H*
NH*;NH*+ H*  NH2*;NH2* + H*
NH2*;NH2* + H*  NH3*
NH3*脱附:NH3*
 NH3(g)
NH3(g)其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。 请回答:
利于提高合成氨平衡产率的条件有__________。
A . 低温 B . 高温 C . 低压 D . 高压 E . 催化剂 -
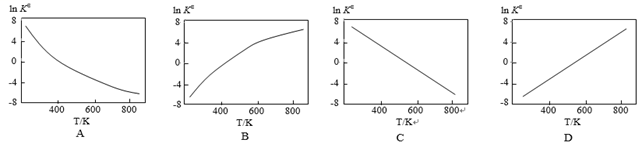
(2) 标准平衡常数KΘ=
 ,其中pΘ为标准压强(1X105Pa),p NH3、 p N2和p H2为各组分的平衡分压,如p NH3=x NH3 p,p为平衡总压,x NH3为平衡系统中NH3的物质的量分数。
,其中pΘ为标准压强(1X105Pa),p NH3、 p N2和p H2为各组分的平衡分压,如p NH3=x NH3 p,p为平衡总压,x NH3为平衡系统中NH3的物质的量分数。 ①起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为w,则KΘ=(用含w的最简式表示)
②下图中可以示意标准平衡常数KΘ随温度T变化趋势的是。
-
(3) 实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0X105Pa,原料中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由。
②关于合成氨工艺的下列理解,正确的是。
A.合成氨反应在不同温度下的△H和△S都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2 , 通过天然气和水蒸气转化可得H2 , 原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
-
(4) (二)高铁酸钾(K2FeO4)可用作水处理剂。某同学通过“化学-电解法”探究的合成,其原理如图所示。接通电源,调节电压,将一定量Cl2通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4。

请写出“化学法”得到FeO42-的离子方程式。
-
(5) 请写出阳极的电极反应式(含FeO42-)。
-
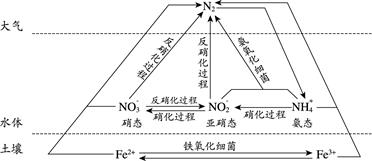
(1) 上图所示氮循环中,属于氮的固定的有(填字母序号)。
a. N2转化为氨态氮 b. 硝化过程 c. 反硝化过程
-
(2) 氮肥是水体中氨态氮的主要来源之一。
①氨气是生产氮肥的主要原料,工业合成氨的化学方程式为。
②检验氨态氮肥中NH4+的实验方案是。
-
(3) 硝化过程中,含氮物质发生(填“氧化”或“还原”)反应。
-
(4) 氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02 mol氮气时,转移的电子的物质的量为 mol。
-
(5) 土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),用离子方程式分别说明利用土壤中的铁循环脱除水体中氨态氮和硝态氮的原理:、。
 2NH3(g) △H<0。电催化还原N2制NH3的一种反应机理如图所示,其中吸附在催化剂表面的微粒用*表示。
2NH3(g) △H<0。电催化还原N2制NH3的一种反应机理如图所示,其中吸附在催化剂表面的微粒用*表示。 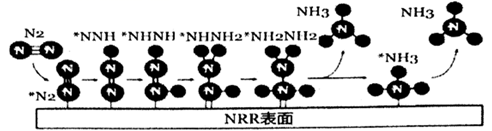
下列说法正确的是( )
-
(1) 科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示,对图中线间距离窄小的部分,其能量差用
 的方式表示。由图可知合成氨反应N2(g)+3H2(g)
的方式表示。由图可知合成氨反应N2(g)+3H2(g)  2NH3(g)的
2NH3(g)的  =kJ·mol-1 , 反应速率最慢的步骤的化学方程式为。
=kJ·mol-1 , 反应速率最慢的步骤的化学方程式为。 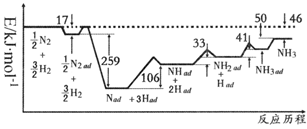
-
(2) 工业合成氨反应为:N2(g)+3H2(g)
 2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示: 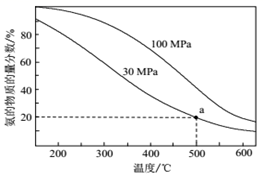
则500℃时:
①平衡常数KP(30MPa)KP(100MPa)。(填“<”、“=”、“>”)
②30MPa时,氢气的平衡转化率为(结果保留3位有效数字)。用平衡分压表示平衡常数KP=(列出计算式即可,不必化简)。
-
(3) 科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观反应过程如图所示,其中电解液为溶解有三氟甲磺酸锂和乙醇的有机溶液。
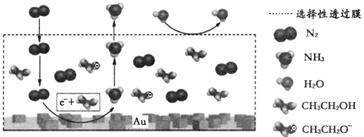
①阴极区生成NH3的电极反应式为。
②下列说法正确的是(填标号)。
A.三氟甲磺酸锂的作用是增强导电性
B.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
C.保持电流强度不变,升高溶液的温度,可以加快电解反应的速率

-
(1) 步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)
 CO(g)+3H2(g)ΔH=+206.4kJ·mol-1
CO(g)+3H2(g)ΔH=+206.4kJ·mol-1②CO(g)+H2O(g)
 CO2(g)+H2(g)ΔH=-41kJ·mol-1
CO2(g)+H2(g)ΔH=-41kJ·mol-1对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是。
a.升高温度 b.减小CO浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若将1molCO和4molH2O的混合气体充入一容积为2L的容器中反应,若第4分钟时达到平衡时放出32.8kJ的能量,则前4分钟的平均反应速率v(CO)为。
-
(2) 步骤Ⅴ的反应原理为N2(g)+3H2(g)
 2NH3(g)ΔH=-92.4kJ·mol-1
2NH3(g)ΔH=-92.4kJ·mol-1 ①合成氨工业采取的下列措施不可用平衡移动原理解释的是(填选项)。
A.采用较高压强(20MPa~50MPa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来
②450℃时该反应的平衡常数500℃时的平衡常数(填“<”“>”或“=”)。
③合成氨工业中通常采用了较高压强(20MPa~50MPa),而没有采用100MPa或者更大压强,理由是。
-
(3) 天然气的主要成分为CH4 , CH4在高温下的分解反应相当复杂,一般情况下温度越高,小分子量的产物就越多,当温度升高至上千度时,CH4就彻底分解为H2和炭黑,反应如下:2CH4
 C+2H2。该反应在初期阶段的速率方程为:r=k×cCH4 , 其中k为反应速率常数。
C+2H2。该反应在初期阶段的速率方程为:r=k×cCH4 , 其中k为反应速率常数。 ①设反应开始时的反应速率为r1 , 甲烷的转化率为α时的反应速率为r2 , 则r2=r1。
②对于处于初期阶段的该反应,下列说法正确的是。
A.增加甲烷浓度,r增大
B.增加氢气浓度,r增大
C.氢气的生成速率逐渐增大
D.降低反应温度,k减小
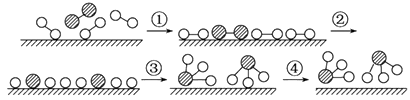
 分子在催化剂的作用下发生的一系列转化示意图:
分子在催化剂的作用下发生的一系列转化示意图: 
下列叙述正确的是( )
 ,降低温度将缩短反应达到平衡的时间
D . 催化剂
,降低温度将缩短反应达到平衡的时间
D . 催化剂  表面反应生成NO时有电子转移
表面反应生成NO时有电子转移

 , 反应速率加快且催化剂的活性更高
C . 步骤③、④、⑤均有利于提高原料平衡的转化率
D . 步骤⑤采用循环操作,主要是为了提高平衡混合物中氨的含量
, 反应速率加快且催化剂的活性更高
C . 步骤③、④、⑤均有利于提高原料平衡的转化率
D . 步骤⑤采用循环操作,主要是为了提高平衡混合物中氨的含量



