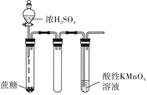
浓硫酸的性质实验 知识点题库
选项 | 操作 | 现象 | 结论 |
A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al浓硝酸不反应 |
C | 将盐酸滴入NaOH溶液 | 无现象 | 盐酸与氢氧化钠不反应 |
D | 将水蒸气通过灼热铁粉 | 粉末变红 | 铁水在高温下发生反应 |
下列实验装置是探究铜丝与过量浓硫酸的反应,下列叙述正确的是( )
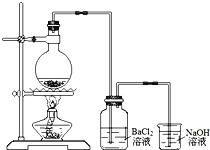
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L﹣1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.
(1)铜和浓硫酸反应的化学方程式为 .
(2)实验结束后,发现广口瓶中产生白色沉淀,加入足量盐酸后沉淀几乎完全溶解.简要分析广口瓶中产生沉淀的主要原因: .
(3)实验结束后,发现烧瓶中有铜片剩余.根据所学知识,他们认为烧瓶中还有较多的硫酸剩余.选择合适的试剂,设计简单易行的实验方案证明有余酸: .供选择的试剂:铁粉、银粉、BaCl2溶液、Na2CO3溶液
(4)甲同学设计如下方案:测定产生气体的量,再计算余酸的浓度.下列测定产生气体的量的实验方法中,不可行的是 (填编号).
a.将气体缓缓通过预先称量、盛有碱石灰的干燥管,反应结束后再次称量
b.将气体通入硫酸酸化的KMnO4溶液,再加足量BaCl2溶液,过滤、洗涤、干燥,称量沉淀
c.用排水法测定产生气体的体积
d.用排饱和NaHSO3的方法测定产生气体的体积
(5)乙同学设计通过酸碱中和滴定来测定余酸的浓度:待烧瓶冷却至室温后,将其中的溶液用蒸馏水稀释至100mL,移取25mL到锥形瓶中,滴加2滴酚酞试液,用标准NaOH溶液滴至终点.平行实验三次.
①稀释时,应先往 (填仪器名称)中加入 (填“烧瓶中的溶液”或“蒸馏水”).
②该方法测得的余酸浓度 (填“偏大”、“偏小”或“准确”).
(6)丙设计了测定余酸浓度的较为简易的实验方案:取出反应后剩余的铜片,进行洗涤、干燥、称量.若称得剩余铜片的质量为3.2g,反应后溶液体积变化忽略不计,则剩余硫酸的物质的量浓度为 .
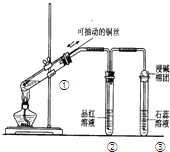
根据如图所示的实验装置,回答下列问题:
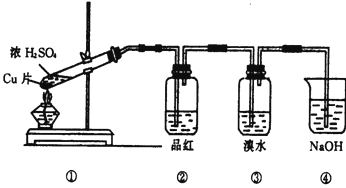
(1)写出铜与浓硫酸反应的化学方程式
(2)证明SO2具有漂白性的现象是 ,再加热该溶液,现象是 .
(3)装置③中的现象是 ,证明SO2具有 .
(4)装置④的作用是
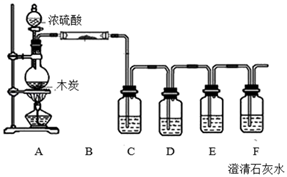
Ⅰ.某课外活动小组为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图1所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉.
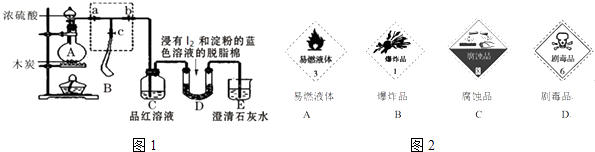
请回答下列问题
-
(1) 对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签如图2.浓硫酸的危险警告标签是.
-
(2) 装置A中发生反应的化学方程式为.
-
(3) 此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
-
(4) 实验时,装置C中的现象为;
-
(5) 当D中产生现象时,可以说明使E中澄清石灰水变浑浊的是CO2 , 而不是SO2;写出D中发生反应的化学方程式,并标出电子转移方向和数目.
-
(6) Ⅱ. Cu与浓硫酸反应可得硫酸铜溶液.某学习小组将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气也可得硫酸铜溶液,其反应原理为2Cu+O2+2H2SO4═2CuSO4+2H2O.现欲将12.8g铜完全溶解,加蒸馏水后得200mL溶液.计算:
参加反应的氧气在标准状况下的体积是L.(不必写计算过程)
-
(7) 所得硫酸铜溶液的物质的量浓度是mol/L(不必写计算过程)
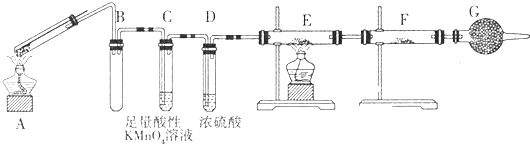
-
(1) G装置的作用是.
-
(2) 证明有SO2生成的现象是,为了证明气体中含有氢气,装置E和F中加入的试剂分别为、.
-
(3) 若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是.
-
(1) 配制不同浓度的硫酸用18.4 mol/L的浓硫酸配制不同浓度的硫酸。下列操作正确的是_____。A .
 量取浓硫酸
B .
量取浓硫酸
B .  稀释浓硫酸
C .
稀释浓硫酸
C .  转移入容量瓶
D .
转移入容量瓶
D .  定容
定容
-
(2) 浓硫酸的吸水性、脱水性、纯化与浓度的关系
①浓硫酸的吸水性:各取0.5g胆矾颗粒于试管中,分别加入3mL不同浓度的硫酸。
②浓硫酸的脱水性:各取一根木柴梗于试臂中,分别加入1mL不同浓度的硫酸。
③浓硫酸的钝化:各取约1cm经过砂纸打磨过的铁丝,再向试管中加入3mL不同浓度的硫酸。
实验结果见下表:
实验
c(H2SO4)/mol/L
18.4
12
11
10
9
8
7
6
1-5
①
胆矾颜色变化
蓝一白
蓝一白
蓝一白
蓝
蓝
蓝
蓝
蓝
蓝
②
木柴梗颜色变化
变黑
变黑
变黑
变黑
变黑
变黑
变黑
变黑
不变
③
铁丝表面气泡
无
无
有
有
有
有
有
有
有
结合表格数据回答下列问题:
用化学方程式表示胆矾由“蓝一白”的原因:;当硫酸的浓度≥mol/L时即具有脱水性。
-
(3) 浓硫酸的强氧化性与浓度的关系
在试管中分别加入1小块铜片,再向试管中分别加入2mL 不同浓度的硫酸,用下图所示的装置进行实验。(夹持仪器略去)
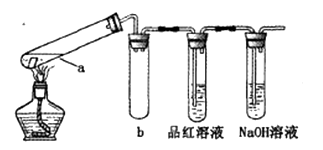
①b装置的作用是
②本实验中证明浓硫酸具有强氧化性的现象是、。
③试管a中加热时产生黑色的固体,经检验该黑色固体中含有Cu2S。写出生成该物质的化学方程式.
④经过实验发现:c(H2SO4)≥ 6mol/L时,硫酸与铜在加热反应时即可表现强氧化性。有同学预测,铜片与5mol/L的硫酸在长时间持续加热时,也会发生反应。该预测的理由是.
-
(4) 综合该小组同学的探究结果,中学教材中同时具有“吸水性、脱水性、使铁钝化、强氧化性”的浓硫酸的浓度范围为mol/L。

-
(1) Ⅰ、蔗糖与浓硫酸的碳化实验会产生大量的有刺激性气味的气体,对环境产生污染。为此,某化学兴趣小组设计了如下装置进行实验。玻璃管中①②③分别为CO检测试纸(遇到CO变黑色)、滴有品红溶液的滤纸、滴有酸性高锰酸钾溶液的滤纸,a和b分别为两个小气球。
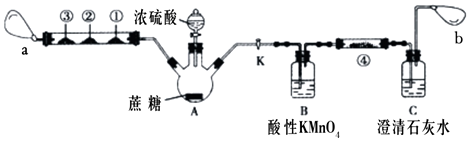
实验步骤如下:按图示连接好仪器,然后检查装置的气密性,装好试剂,夹紧止水夹K,向A瓶中的蔗糖上小心滴加浓硫酸,片刻后可观察到A瓶内蔗糖变黑,体积膨胀,有白雾产生,气球a鼓起,玻璃管中①号滤纸白色变黑色,②号和③号滤纸均褪色。请回答以下问题:
上图中盛有浓硫酸的仪器名称为。
-
(2) 根据实验中滤纸的现象说明SO2具有的性质分别是:②号;③号。
A.氧化性
B.还原性
C.漂白性
D.酸性氧化物通性
-
(3) B瓶中酸性高锰酸钾溶液的作用是,发生反应的离子方程式为。
-
(4) 打开止水夹K,使气球a内气体缓慢通过B瓶和C瓶,一段时间后,发现澄清石灰水变浑浊,但此现象并不能证明该反应生成了CO2 , 为了证明有CO2生成并简化实验装置,可在④号装置放上滴有的滤纸。
A.品红溶液
B.酸性高锰酸钾
C.溴水
D.澄清石灰水
-
(5) Ⅱ、某化学课外活动小组对污染大气的部分非金属氧化物进行探究,请根据题目要求回答下列问题:
写出用硝酸制取NO的离子方程式。
-
(6) 查资料得知HCOOH
 CO+H2O,实验室有如图所示的装置,制取CO气体可选用的装置为(填序号),实验室利用该装置还可以制取的气体有(写一种气体的分子式)。
CO+H2O,实验室有如图所示的装置,制取CO气体可选用的装置为(填序号),实验室利用该装置还可以制取的气体有(写一种气体的分子式)。
-
(7) 查资料得知,利用催化剂可使汽车尾气中的CO和氮氧化物大部分发生反应转化为二氧化碳和氮气。该小组在实验室模拟汽车尾气处理,设计了如图2所示装置(部分夹持装置已略去)。
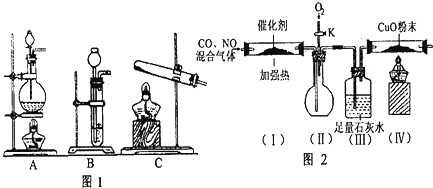
①实验前,关闭旋塞K,先通氮气排净装置中的空气,其目的是。
②装置(Ⅲ)的主要作用是。
③该套装置中有不完善之处,还应在装置(Ⅳ)后补充装置。
-
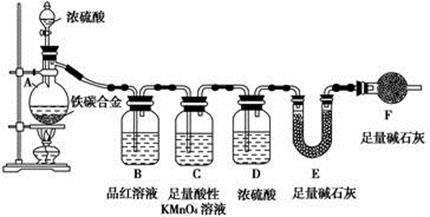
(1) 取ag合金粉末放入蒸馏烧瓶,并加入足量浓硫酸,A、B中均无明显现象,原因是。
-
(2) 反应一段时间后,B中的现象为。
-
(3) 装置C的作用是;装置D的作用是,F的作用是。
-
(4) 反应结束后,若U形管E增重m g,则合金中碳的质量分数为。(用含m和a的式子表示)
| 选项 | A | B | C | D |
| 方案 | | | | |
| 目的 | 验证浓硫酸的吸水性和脱水性 | 验证苯和液溴能发生取代反应 | 除去甲烷、乙烯混合气中的乙烯 | 比较乙醇中羟基氢原子和水分子氢原子的活泼性 |
-
(1) 写出A中木炭与浓硫酸反应的化学方程式。
-
(2) B中盛放的试剂X为,现象变化为。
-
(3) C中盛放溶液,先检验气体。
-
(4) D中可以盛放的试剂是。
①NaOH溶液 ②饱和NaHCO3溶液 ③酸性高锰酸钾溶液 ④饱和NaHSO3溶液
-
(5) 若要证明木炭与浓硫酸反应产生了CO2气体,可依据的实验现象是。
 的转化且充分利用能量。在热交换器接触室中装有热交换器(如图),温度最低的是( )
的转化且充分利用能量。在热交换器接触室中装有热交换器(如图),温度最低的是( )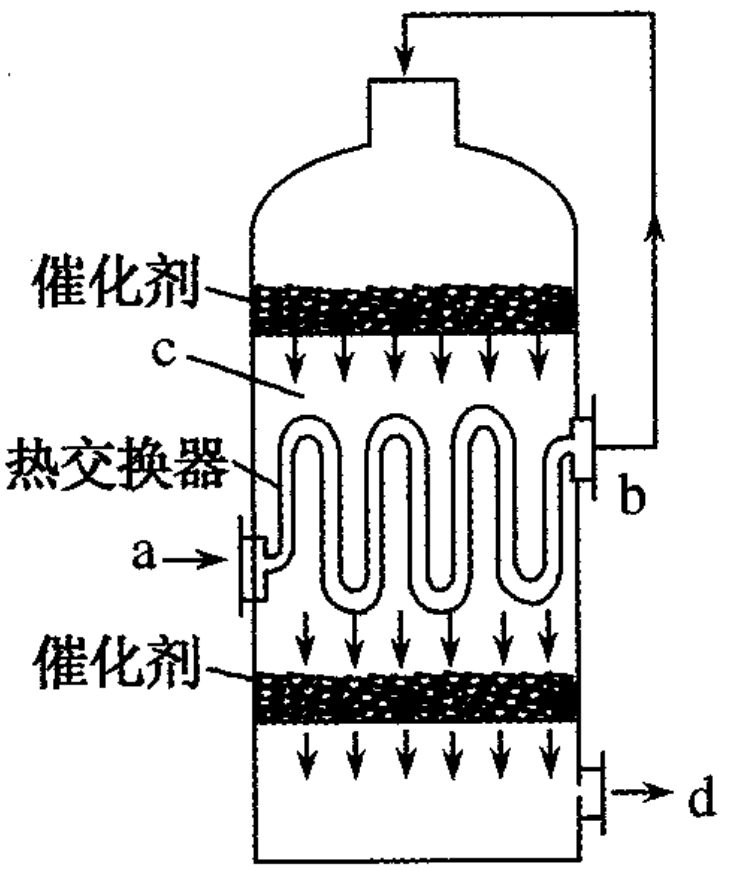
I.将光亮铜丝插入浓硫酸,加热;
II.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
III.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
-
(1) 步骤II产生的气体是。
-
(2) 该同学假设黑色沉淀是CuO。检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加
 溶液,若产生红褐色沉淀,证明有Cu2+。
溶液,若产生红褐色沉淀,证明有Cu2+。①将CuO放入稀硫酸中,一段时间后,再滴加
 溶液,产生红褐色沉淀。
溶液,产生红褐色沉淀。②将黑色沉淀放入稀硫酸中,一段时间后,滴加
 溶液,未见红褐色沉淀。由该检验过程所得结论是:该黑色沉淀CuO(填写“含有”或“不含”)
溶液,未见红褐色沉淀。由该检验过程所得结论是:该黑色沉淀CuO(填写“含有”或“不含”) -
(3) 再次假设,黑色沉淀是铜的硫化物。实验如下:
实验装置
现象
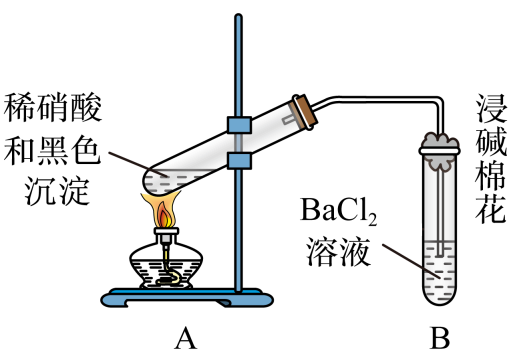
1.A试管中黑色沉淀逐渐溶解
2.A试管内上方出现红棕色气体
3.B试管中出现白色沉淀
①现象2说明黑色沉淀具有性(填写“氧化性”或“还原性”)
②请写出在试管上方由无色气体转变为红棕色气体的化学方程式。
③能确认黑色沉淀中含有S元素的现象是。
④为确认黑色沉淀是否含有二价铜,需要进行的实验是。
-
(4) 以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入足量浓硫酸中加热一段时间后,黑色沉淀完全溶解,得到澄清溶液,其中CuS溶解的化学方程式是。