陕西省宝鸡市渭滨高中2021届高三上册第一次月考化学免费试卷带答案和解析
| 1. 选择题 | 详细信息 |
|
我国湖笔的制作技艺属于国家非物质文化遗产,相传古人制作毛笔的过程为“以枯木为管,鹿毛为柱,羊毛为被(外衣)”,下列说法不正确的是( ) A.枯木、鹿毛、羊毛的主要成分均为天然高分子化合物,且均能水解 B.枯木等木材隔绝空气加强热可以得到焦炭、苯、甲苯等 C.鹿毛的成分中一定含有C、H、O、N元素 D.采用灼烧法可以区分毛笔的“外衣”是羊毛还是化学纤维 |
|
| 2. 选择题 | 详细信息 |
|
新冠肺炎疫情出现以来,一系列举措体现了中国力量。在各种防护防控措施中,化学知识起了重要作用,下列有关说法错误的是( ) A.使用84消毒液杀菌消毒是利用HClO或ClO-的强氧化性 B.使用医用酒精杀菌消毒的过程中只发生了物理变化 C.N95型口罩的核心材料是聚丙烯,属于有机高分子材料 D.医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯属于卤代烃 |
|
| 3. 选择题 | 详细信息 |
|
只需用一种试剂即可将酒精、苯酚溶液、四氯化碳、己烯、甲苯五种无色液体区分开来,该试剂是( ) A.FeCl3溶液 B.金属钠 C.酸性KMnO4溶液 D.溴水 |
|
| 4. 选择题 | 详细信息 |
有机物M是合成治疗癌症的药物中间物质,其结构简式如图所示,则下列说法正确的是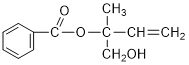 A.有机物M和油脂都含有 B.M在一定条件下能发生加聚反应,不能发生酯化反应 C.在Ni作催化剂的条件下,1 mol M最多只能与1molH2加成 D.不可用酸性高锰酸钾溶液区分苯和M |
|
| 5. 选择题 | 详细信息 |
|
下列有关化学实验的操作或说法中,正确的是( ) A. 苯酚中滴加少量的稀溴水出现了三溴苯酚的白色沉淀 B. 检验C2H5Cl 中氯原子时,将C2H5Cl 和NaOH溶液混合加热后,加入稀硫酸进行酸化 C. 用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 D. 制取溴苯应用液溴 , 铁屑和苯的混合,反应后并用稀碱液洗涤 |
|
| 6. 选择题 | 详细信息 | |||||||||||||||
下列实验方案中,不能达到实验目的是( )
|
||||||||||||||||
| 7. 选择题 | 详细信息 |
|
分子式为 C5H10O2 并能与饱和 NaHCO3 溶液反应放出气体的有机物有 (不含立体异构)( ) A.3 种 B.4 种 C.5 种 D.6 种 |
|
| 8. 选择题 | 详细信息 |
|
下列说法不正确的是 ( ) A. O2和O3互为同素异形体 B. H、H和H互为同位素 C. CH2===CH2和 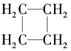 互为同系物 互为同系物D. |
|
| 9. 选择题 | 详细信息 |
|
下列实验操作正确且能达到对应实验目的的是( ) A. 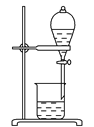 分离碘和四氯化碳 分离碘和四氯化碳B. 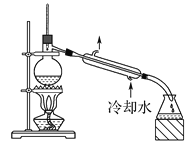 蒸馏75%的酒精溶液制备无水酒精 蒸馏75%的酒精溶液制备无水酒精C. 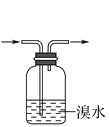 除去乙烷中的乙烯 除去乙烷中的乙烯D.  提纯乙酸乙酯 提纯乙酸乙酯 |
|
| 10. 选择题 | 详细信息 |
|
下列溶液中,物质的量浓度最大的是 A. 1 L H2SO4溶液中含98 g H2SO4 B. 0.5 L含49 g H2SO4的溶液 C. 98 g H2SO4溶于水配成2 L溶液 D. 0.1 L含24.5 g H2SO4的溶液 |
|
| 11. 选择题 | 详细信息 |
|
下列判断中一定正确的是( ) A. CaCl2及CaO2固体中阴、阳离子数之比均为2∶1 B. 等质量的O2与O3中,氧原子的个数比为3∶2 C. 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1∶2 D. 10mL 0.3mol·L-1NaCl与30mL0.1mol·L-1AlCl3溶液中Cl-物质的量浓度比为1∶3 |
|
| 12. 选择题 | 详细信息 |
|
下列表述正确的是 A.22.4LHCl溶于水制得1L盐酸时,其浓度为1 mol•L-1 B.1L0.3mol•L-1的CuCl2溶液中含有Cu2+和Cl-的总物质的量为0.9mol C.在K2SO4和NaCl的中性混合水溶液中,如果c(Na+)=c(SO42-),则c(K+)=c(Cl-) D.10℃时,100mLKCl饱和溶液蒸发掉5g水,冷却到10℃时,它仍为饱和溶液 |
|
| 13. 选择题 | 详细信息 |
|
设 A.1 mol甲苯分子最多共平面的原子个数为 B.在标准状况下,4.48L环己烷含氢原子个数为 C. D. |
|
| 14. 选择题 | 详细信息 |
|
下列化学用语的表述正确的是( ) A.乙酸与乙醇的酯化反应: CH3COOH+C2H5l8OH=CH3COOC2H5+H218O B.镁离子的结构示意图: C.二氧化碳分子的比例模型: D.NaCl 溶液导电: NaCl |
|
| 15. 选择题 | 详细信息 |
|
117号元素Ts的原子最外层电子数是7,下列说法不正确的是 A.Ts是第七周期第ⅦA族元素 B.还原性:I−<Ts− C.原子半径:I<Ts D.中子数为176的Ts的核素符号: |
|
| 16. 选择题 | 详细信息 |
|
下列除杂质的方法可行的是( ) A. 除去NaHCO3溶液中少量的Na2CO3:加入适量稀盐酸 B. 除去FeCl2溶液中少量的FeCl3:加入稍过量铁粉,过滤 C. 除去NH4Cl固体中少量I2:加热,I2升华除去 D. 除去乙烯中的少量SO2:通过酸性KMnO4溶液,洗气 |
|
| 17. 选择题 | 详细信息 | |||||||||||||||
下列实验中的颜色变化,与氧化还原反应无关的是
|
||||||||||||||||
| 18. 选择题 | 详细信息 |
|
在pH=1的无色溶液中能大量共存的离子组是( ) A.Na+ AlO B.NH C.MnO D.Fe2+ NO |
|
| 19. 选择题 | 详细信息 |
|
下列化学方程式中,不能正确表达反应颜色变化的是( ) A.向CuSO4溶液中加入足量Zn粉,溶液蓝色消失:Zn+CuSO4=Cu+ZnSO4 B.澄清的石灰水久置后出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O C.Na2O2在空气中放置后由淡黄色变为白色:2Na2O2=2Na2O+O2↑ D.向FeCl2溶液中通入Cl2,溶液变为棕黄色:2FeCl2+Cl2=2FeCl3 |
|
| 20. 填空题 | 详细信息 |
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示: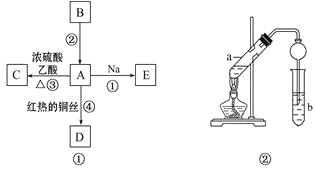 (1)写出B的结构简式______________;A中官能团的名称为______________。 (2) 写出下列反应的化学方程式 反应①________________________________________________________ 反应④________________________________________________________ (3) 实验室利用反应③制取C,常用上图②装置: ①a试管中的主要化学反应的方程式为:____________________________________。 ② 在实验中球形干燥管除起冷凝作用外,另一个重要作用是_____________。 ③ 试管b中观察到的现象是________________________________________。 |
|
| 21. 实验题 | 详细信息 |
|
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案。 方案一 滴定法:用酸性KMnO4溶液滴定,测定铁元素的含量 (1)写出该滴定反应的离子方程式 。 (2)某同学设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号) 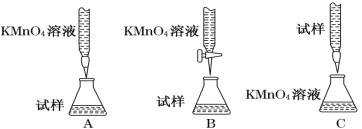 (3)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、药匙、烧杯、胶头滴管外,还需 (填仪器名称)。 在溶液配制过程中,下列操作会导致配制结果偏低的是___________(填写代号)。 a. 定容时,俯视容量瓶刻度线 b. 容量瓶在使用前内有少量蒸馏水 c. 转移溶液后的烧杯、玻璃棒未洗涤 d. 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线 (4)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。 a.浓盐酸 b.稀硫酸 c.稀硝酸 d.浓硫酸 方案二 称量法:操作流程如下: 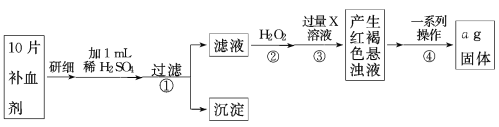 (5)写出步骤②中H2O2氧化Fe2+ 的离子方程式______ __。 步骤②中除用H2O2外还可以使用的物质是 步骤②是否可以省略 ,理由是 。 (6)步骤④一系列操作依次是:过滤、洗涤、 、冷却、称量。 (7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。 |
|
| 22. 填空题 | 详细信息 |
|
东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题: (1)镍元素的基态价电子排布式为_____________,3d能级上的未成对的电子数为______。 (2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。 ①[Ni(NH3)6]SO4中阴离子的立体构型是___________。 ②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______________,提供孤电子对的成键原子是_____________。 ③氨的沸点_________(填“高于”或“低于”)膦(PH3),原因是__________________;氨是_________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。 (3)单质铜及镍都是由______________键形成的晶体。 (4)某镍白铜合金的立方晶胞结构如图所示。 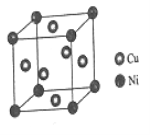 ①晶胞中铜原子与镍原子的数量比为___________。 ②若合金的密度为dg/cm3,晶胞边长a=______________nm。 |
|
最近更新



