й«ҳдёӯ еҢ–еӯҰ
 B .
B .  C .
C .  D .
D . 
-
пјҲ1пјү дҝЎжҒҜжҠҖжңҜзҰ»дёҚејҖиҠҜзүҮпјҢзҺ°д»ЈиҠҜзүҮзҰ»дёҚејҖй«ҳзәҜеәҰзҡ„зЎ…пјҢе·ҘдёҡдёҠз”ҹдә§й«ҳзәҜзЎ…зҡ„е·ҘиүәжөҒзЁӢеҰӮдёӢпјҡ

в‘ зЎ…йҷӨз”ЁдәҺеҲ¶йҖ иҠҜзүҮеӨ–пјҢеңЁиғҪйҮҸиҪ¬еҢ–ж–№йқўд№ҹжңүжһҒдёәйҮҚиҰҒзҡ„з”ЁйҖ”пјҢиҜҘз”ЁйҖ”жҳҜ(еЎ«дёҖз§Қ)пјҢеҶҷеҮәеҲ¶еӨҮзІ—зЎ…еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡгҖӮ
в‘ЎиҝҮзЁӢв‘ЎжҳҜзҪ®жҚўеҸҚеә”пјҢеҲҷиҜҘеҸҚеә”дёӯеҫ—еҲ°зҡ„еҚ•иҙЁдёә(еЎ«еҢ–еӯҰејҸ)гҖӮ
-
пјҲ2пјү зўізәізұіжқҗж–ҷжҳҜдёҖз§Қе…·жңүйҮҚиҰҒз”ЁйҖ”зҡ„ж–°еһӢж— жңәйқһйҮ‘еұһжқҗж–ҷпјҢе…¶дёӯ
 зҡ„еҢ–еӯҰжҖ§иҙЁдёҺйҮ‘еҲҡзҹі(еЎ«вҖңзӣёдјјвҖқжҲ–вҖңдёҚеҗҢвҖқ)пјҢ
зҡ„еҢ–еӯҰжҖ§иҙЁдёҺйҮ‘еҲҡзҹі(еЎ«вҖңзӣёдјјвҖқжҲ–вҖңдёҚеҗҢвҖқ)пјҢ е®Ңе…ЁзҮғзғ§ж—¶йңҖиҰҒж¶ҲиҖ—
е®Ңе…ЁзҮғзғ§ж—¶йңҖиҰҒж¶ҲиҖ— пјҢ иҜҘеҸҚеә”дјҡ(еЎ«вҖңеҗёж”¶вҖқжҲ–вҖңйҮҠж”ҫвҖқ)иғҪйҮҸгҖӮ
пјҢ иҜҘеҸҚеә”дјҡ(еЎ«вҖңеҗёж”¶вҖқжҲ–вҖңйҮҠж”ҫвҖқ)иғҪйҮҸгҖӮ
жӯҘйӘӨдёҖпјҡеҸ–ж ·е“Ғ2.100gз”ЁзЁҖзЎ«й…ёе……еҲҶжә¶и§Јеҫ—еҲ° жә¶ж¶ІпјҢеҶҚз”Ёи¶ійҮҸй“қе°Ҷ
жә¶ж¶ІпјҢеҶҚз”Ёи¶ійҮҸй“қе°Ҷ иҝҳеҺҹдёә
иҝҳеҺҹдёә пјҢ иҝҮж»Ө并жҙ—ж¶ӨпјҢе°ҶжүҖеҫ—ж»Өж¶Іе’Ңжҙ—ж¶Өж¶Іж··еҗҲ并注е…Ҙ250mLе®№йҮҸ瓶пјҢе®ҡе®№еҫ—еҲ°еҫ…жөӢж¶ІгҖӮ
пјҢ иҝҮж»Ө并жҙ—ж¶ӨпјҢе°ҶжүҖеҫ—ж»Өж¶Іе’Ңжҙ—ж¶Өж¶Іж··еҗҲ并注е…Ҙ250mLе®№йҮҸ瓶пјҢе®ҡе®№еҫ—еҲ°еҫ…жөӢж¶ІгҖӮ
жӯҘйӘӨдәҢпјҡеҸ–еҫ…жөӢж¶ІдәҺй”ҘеҪўз“¶дёӯпјҢеҠ е…ҘеҮ ж»ҙжҢҮзӨәеүӮпјҢз”Ё зҡ„
зҡ„ ж ҮеҮҶжә¶ж¶Іж»ҙе®ҡпјҢе°Ҷ
ж ҮеҮҶжә¶ж¶Іж»ҙе®ҡпјҢе°Ҷ ж°§еҢ–дёә
ж°§еҢ–дёә дёүж¬Ўж»ҙе®ҡжөӢеҫ—ж•°жҚ®и®°еҪ•еҰӮдёӢпјҡ
дёүж¬Ўж»ҙе®ҡжөӢеҫ—ж•°жҚ®и®°еҪ•еҰӮдёӢпјҡ
|
е®һйӘҢзј–еҸ· |
еҫ…жөӢжә¶ж¶Ізҡ„дҪ“з§Ҝ/mL |
ж»ҙе®ҡеүҚж ҮеҮҶж¶Ізҡ„дҪ“з§ҜиҜ»ж•°/mL |
ж»ҙе®ҡеҗҺж ҮеҮҶж¶Ізҡ„дҪ“з§ҜиҜ»ж•°/mL |
|
1 |
25.00 |
0.20 |
24.22 |
|
2 |
25.00 |
1.21 |
29.21 |
|
3 |
25.00 |
1.50 |
25.48 |
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү иӢҘеҜ№жӯҘйӘӨдёҖжүҖеҫ—зҡ„
 жә¶ж¶ІеҠ ж°ҙзЁҖйҮҠпјҢжә¶ж¶Ідёӯдјҡдә§з”ҹе°‘йҮҸеҒҸй’ӣй…ё
жә¶ж¶ІеҠ ж°ҙзЁҖйҮҠпјҢжә¶ж¶Ідёӯдјҡдә§з”ҹе°‘йҮҸеҒҸй’ӣй…ё жІүж·ҖпјҢеҶҷеҮәиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸгҖӮ
жІүж·ҖпјҢеҶҷеҮәиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸгҖӮ
-
пјҲ2пјү ж»ҙе®ҡж—¶пјҢе°Ҷж ҮеҮҶжә¶ж¶ІжіЁе…Ҙ(еЎ«вҖңй…ёвҖқжҲ–вҖңзўұвҖқ)ејҸж»ҙе®ҡз®ЎдёӯгҖӮйҖүеҮәе…¶жӯЈзЎ®ж“ҚдҪң并жҢүйЎәеәҸеҶҷеҮәеӯ—жҜҚпјҡжЈҖжҹҘж»ҙе®ҡз®ЎжҳҜеҗҰжјҸж°ҙвҶ’и’ёйҰҸж°ҙжҙ—ж¶ӨвҶ’вҶ’вҶ’вҶ’вҶ’вҶ’вҶ’ж»ҙе®ҡз®ЎеҮҶеӨҮе®ҢжҲҗгҖӮ
aпјҺд»Һж»ҙе®ҡз®ЎдёҠеҸЈеҠ е…Ҙй«ҳдәҺвҖң0вҖқеҲ»еәҰ3mLжүҖиҰҒзӣӣиЈ…зҡ„жә¶ж¶І
bпјҺд»Һж»ҙе®ҡз®ЎдёҠеҸЈеҠ е…Ҙ3mLжүҖиҰҒзӣӣиЈ…зҡ„жә¶ж¶ІпјҢеҖҫж–ңзқҖиҪ¬еҠЁж»ҙе®ҡз®Ў
cпјҺе°Ҷжҙ—ж¶Өж¶Ід»Һж»ҙе®ҡз®ЎдёҠеҸЈеҖ’е…Ҙйў„зҪ®зҡ„зғ§жқҜдёӯ
dпјҺе°Ҷжҙ—ж¶Өж¶Ід»Һж»ҙе®ҡз®ЎдёӢйғЁж”ҫе…Ҙйў„зҪ®зҡ„зғ§жқҜдёӯ
eпјҺи°ғж•ҙж¶ІйқўиҮівҖң0вҖқеҲ»еәҰжҲ–вҖң0"еҲ»еәҰд»ҘдёӢпјҢи®°еҪ•ж•°жҚ®
fпјҺиҪ»иҪ»иҪ¬еҠЁжҙ»еЎһдҪҝж»ҙе®ҡз®Ўзҡ„е°–еҳҙйғЁеҲҶе……ж»Ўжә¶ж¶ІпјҢж— ж°”жіЎ
gпјҺиҪ»иҪ»жҢӨеҺӢзҺ»з’ғзҗғдҪҝж»ҙе®ҡз®Ўзҡ„е°–еҳҙйғЁеҲҶе……ж»Ўжә¶ж¶ІпјҢж— ж°”жіЎ
-
пјҲ3пјү дёҠиҝ°ж»ҙе®ҡе®һйӘҢдёӯпјҢеҸҜйҖүжӢ©дёәжҢҮзӨәеүӮпјҢеҲӨж–ӯеҲ°иҫҫж»ҙе®ҡз»ҲзӮ№зҡ„ж–№жі•жҳҜгҖӮ
-
пјҲ4пјү дёӢеҲ—е…ідәҺж»ҙе®ҡеҲҶжһҗзҡ„ж“ҚдҪңпјҢй”ҷиҜҜзҡ„жҳҜ____гҖӮA . ж»ҙе®ҡж—¶иҰҒйҖӮеҪ“жҺ§еҲ¶ж»ҙе®ҡйҖҹзҺҮ B . з”ЁйҮҸзӯ’йҮҸеҸ–25.00mLеҫ…жөӢж¶ІиҪ¬з§»иҮій”ҘеҪўз“¶ C . ж»ҙе®ҡж—¶еә”дёҖзӣҙи§ӮеҜҹж»ҙе®ҡз®Ўдёӯжә¶ж¶ІдҪ“з§Ҝзҡ„еҸҳеҢ– D . е№іиЎҢж»ҙе®ҡж—¶пјҢйЎ»йҮҚ新装液并и°ғиҠӮж¶ІйқўиҮівҖң0вҖқеҲ»еәҰжҲ–вҖң0вҖқеҲ»еәҰд»ҘдёӢ E . иҜ»ж•°ж—¶еҸҜе°Ҷж»ҙе®ҡз®Ўд»Һжһ¶дёҠеҸ–дёӢпјҢжҚҸдҪҸз®ЎдёҠз«Ҝж— еҲ»еәҰеӨ„пјҢдҪҝж»ҙе®ҡз®ЎдҝқжҢҒеһӮзӣҙ F . еңЁжҺҘиҝ‘з»ҲзӮ№ж—¶пјҢж»ҙеҠ иҚҜе“Ғеә”ж…ўж…ўжҺ§еҲ¶ж»ҙе®ҡз®ЎпјҢдҪҝж»ҙе®ҡз®Ўе°–еҳҙжӮ¬жҢӮдёҖж»ҙж¶ІдҪ“пјҢз”Ёй”ҘеҪўз“¶еҶ…еЈҒе°Ҷе…¶йқ дёӢпјҢ并用蒸йҰҸж°ҙе°Ҷе…¶еҶІе…Ҙй”ҘеҪўз“¶еҶ…гҖӮ
-
пјҲ5пјү йҖҡиҝҮеҲҶжһҗгҖҒи®Ўз®—пјҢиҜҘж ·е“Ғзҡ„з»„жҲҗдёәпјҢиӢҘж»ҙе®ҡеүҚж»ҙе®ҡз®Ўе°–з«Ҝжңүж°”жіЎпјҢж»ҙе®ҡиҝҮзЁӢдёӯж°”жіЎж¶ҲеӨұпјҢеҲҷжөӢеҫ—
 жҜ”е®һйҷ…еҖј(еЎ«вҖңеҒҸеӨ§вҖқгҖҒвҖңеҒҸе°ҸвҖқжҲ–вҖңж— еҪұе“ҚвҖқ)гҖӮ
жҜ”е®һйҷ…еҖј(еЎ«вҖңеҒҸеӨ§вҖқгҖҒвҖңеҒҸе°ҸвҖқжҲ–вҖңж— еҪұе“ҚвҖқ)гҖӮ
иЈ…зҪ® |
|
|
|
зҺ°иұЎ | дәҢд»·йҮ‘еұһAдёҚж–ӯжә¶и§Ј | CжһҒиҙЁйҮҸеўһеҠ | AдёҠжңүж°”дҪ“дә§з”ҹ |
ж №жҚ®е®һйӘҢзҺ°иұЎеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү иЈ…зҪ®з”ІдёӯиҙҹжһҒзҡ„з”өжһҒеҸҚеә”ејҸжҳҜпјӣ
-
пјҲ2пјү иЈ…зҪ®д№ҷдёӯжӯЈжһҒзҡ„з”өжһҒеҸҚеә”ејҸжҳҜпјӣ
-
пјҲ3пјү иЈ…зҪ®дёҷдёӯжә¶ж¶Ізҡ„pHпјҲеЎ«вҖңеҸҳеӨ§вҖқжҲ–вҖңеҸҳе°ҸвҖқжҲ–вҖңдёҚеҸҳвҖқпјүпјӣ
-
пјҲ4пјү еӣӣз§ҚйҮ‘еұһжҙ»еҠЁжҖ§з”ұејәеҲ°ејұзҡ„йЎәеәҸжҳҜ

-
пјҲ1пјү иҜ•з®Ўв… дёӯзӣӣжңүз”ұ2mLжө“зЎ«й…ёгҖҒ3mLд№ҷйҶҮгҖҒ2mLеҶ°йҶӢй…ёз»„жҲҗзҡ„еҸҚеә”ж··еҗҲж¶ІпјҢе…¶дёӯжө“зЎ«й…ёзҡ„дҪңз”ЁжҳҜ
в‘ еӮ¬еҢ–еүӮе’Ңеҗёж°ҙеүӮ в‘Ўи„ұж°ҙеүӮпјҲ пјү
-
пјҲ2пјү иҜ•з®Ўдёӯзҡ„еҜјз®ЎеҸЈдёәд»Җд№ҲиҰҒеңЁж¶Ійқўд№ӢдёҠ?
в‘ йҳІжӯўеҖ’еҗё в‘ЎжңүеҲ©дәҺж°”дҪ“еҜјеҮәпјҲ пјү
-
пјҲ3пјү йҘұе’Ңзҡ„Na2CO3жә¶ж¶Ізҡ„дё»иҰҒдҪңз”ЁжҳҜпјҲдёҚе®ҡйЎ№пјүпјҲ пјү
в‘ йҷҚдҪҺд№ҷй…ёд№ҷй…ҜеңЁжә¶ж¶Ідёӯзҡ„жә¶и§ЈеәҰпјӣв‘ЎйҷӨеҺ»жҢҘеҸ‘еҮәзҡ„д№ҷй…ёпјӣв‘ўжә¶и§ЈжҢҘеҸ‘еҮәзҡ„д№ҷйҶҮгҖӮ
-
пјҲ4пјү еҶҷеҮәз”ҹжҲҗд№ҷй…ёд№ҷй…Ҝзҡ„еҢ–еӯҰж–№зЁӢејҸпјҡгҖӮ
 2SO3пјҲgпјүпјҺе·ІзҹҘеҸҚеә”иҝҮзЁӢдёӯжҹҗдёҖж—¶еҲ»SO2гҖҒO2гҖҒSO3зҡ„жө“еәҰеҲҶеҲ«дёә0.4mol/LгҖҒ0.2mol/LгҖҒ0.4mol/LпјҺеҪ“еҸҚеә”иҫҫеҲ°е№іиЎЎж—¶пјҢеҸҜиғҪеӯҳеңЁзҡ„ж•°жҚ®жҳҜпјҲ пјү
2SO3пјҲgпјүпјҺе·ІзҹҘеҸҚеә”иҝҮзЁӢдёӯжҹҗдёҖж—¶еҲ»SO2гҖҒO2гҖҒSO3зҡ„жө“еәҰеҲҶеҲ«дёә0.4mol/LгҖҒ0.2mol/LгҖҒ0.4mol/LпјҺеҪ“еҸҚеә”иҫҫеҲ°е№іиЎЎж—¶пјҢеҸҜиғҪеӯҳеңЁзҡ„ж•°жҚ®жҳҜпјҲ пјү
еҲ©з”Ёй“ңе’Ңжө“H2SO4еңЁеҠ зғӯжқЎд»¶дёӢд№ҹиғҪеҲ¶еӨҮCuSO4жә¶ж¶ІпјҢе…¶еҢ–еӯҰж–№зЁӢејҸдёәпјҡ пјҺд»ҘдёҠдёӨз§Қж–№жі•жҳҜеүҚиҖ…еҘҪиҝҳжҳҜеҗҺиҖ…еҘҪпјҡ пјҺ
еҺҹеӣ жҳҜ
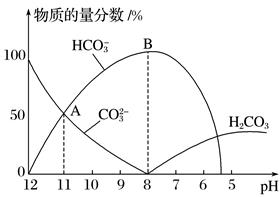
дёӢеҲ—е®һйӘҢж“ҚдҪңеҸҜиғҪдјҡеҜјиҮҙе®һйӘҢз»“жһңеҒҸй«ҳзҡ„жҳҜпјҲ пјү
A.й…ҚеҲ¶дёҖе®ҡзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„жә¶ж¶Іпјҡз§°йҮҸеӣәдҪ“ж—¶зү©дҪ“дёҺз қз Ғж”ҫзҪ®йў еҖ’
B.й…ҚеҲ¶дёҖе®ҡзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„жә¶ж¶Іпјҡе®ҡе®№ж—¶д»°и§ҶеҲ»еәҰзәҝ
C.й…ёзўұдёӯе’Ңж»ҙе®ҡпјҡеҗ‘ж»ҙе®ҡз®ЎдёӯиЈ…е…Ҙж ҮеҮҶж¶ІеүҚпјҢжңӘж¶Ұжҙ—ж»ҙе®ҡз®Ў
D.й…ёзўұдёӯе’Ңж»ҙе®ҡпјҡж»ҙе®ҡз»“жқҹеҗҺпјҢиҜ»еҸ–ж ҮеҮҶж¶Ізҡ„дҪ“з§Ҝж—¶пјҢдҝҜи§ҶеҲ»еәҰзәҝ
дёӢеҲ—зү©иҙЁеҸҠе…¶з”ЁйҖ”дёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
A.й”Ӯз”өжұ жҳҜж–°дёҖд»ЈеҸҜе……з”өзҡ„з»ҝиүІз”өжұ пјҢжҲҗдёә笔记жң¬з”өи„‘гҖҒ移еҠЁз”өиҜқзӯүдҪҺеҠҹиҖ—з”өеҷЁзҡ„дё»жөҒз”өжұ
B.й“ңзӣҗжә¶ж¶ІйғҪжңүжҜ’пјҢдҪҶзЎ«й…ёй“ңеёёз”ЁжқҘй…ҚеҲ¶з”өи§Јж¶Іе’ҢеҶңиҚҜпјӣиҖҢдё”еңЁз”ҹе‘ҪдҪ“дёӯпјҢй“ңд№ҹжҳҜдёҖз§ҚдёҚеҸҜзјәе°‘зҡ„еҫ®йҮҸе…ғзҙ
C.зҺ»з’ғгҖҒж°ҙжіҘгҖҒйҷ¶з“·е’Ңй»ҸеңҹйғҪжҳҜзЎ…й…ёзӣҗдә§е“ҒпјҢеә”з”ЁдәҺз”ҹдә§гҖҒз”ҹжҙ»зҡ„еҗ„дёӘйўҶеҹҹ
D.ж°ЁжҳҜдёҖз§ҚйҮҚиҰҒзҡ„еҢ–е·Ҙдә§е“ҒпјҢжҳҜж°®иӮҘе·ҘдёҡгҖҒжңүжңәеҗҲжҲҗе·ҘдёҡеҸҠеҲ¶йҖ зЎқй…ёгҖҒй“өзӣҗе’ҢзәҜзўұзҡ„еҺҹж–ҷ
2020 е№ҙзӘҒеҰӮе…¶жқҘзҡ„ вҖң ж–°еҶ иӮәзӮҺ вҖқ дҪҝдәә们и®ӨиҜҶеҲ°ж—ҘеёёжқҖиҸҢж¶ҲжҜ’зҡ„йҮҚиҰҒжҖ§гҖӮж°Ҝж°”гҖҒжјӮзҷҪж¶ІгҖҒжјӮзҷҪзІүйғҪжҳҜз”ҹжҙ»дёӯеёёз”Ёзҡ„еҗ«ж°Ҝж¶ҲжҜ’еүӮгҖӮ家еәӯдёӯеёёеёёдҪҝз”Ёзҡ„ж¶ҲжҜ’еүӮдё»иҰҒжҳҜ вҖң 84 вҖқж¶ҲжҜ’ж¶ІпјҢеҸҜд»ҘиҜҙеҢ–еӯҰи®©з”ҹжҙ»жӣҙзҫҺеҘҪгҖӮеӣҫдёәвҖң 84 вҖқж¶ҲжҜ’ж¶ІиҜҙжҳҺд№ҰгҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳгҖӮ
| иҜҙжҳҺд№Ұ | иҚҜе“ҒеҗҚз§° | 84 ж¶ҲжҜ’ж¶І |
| дё»иҰҒжҲҗеҲҶ | NaClO пјҢжңүж•Ҳж°Ҝеҗ«йҮҸ 50.00g/L~60.00g/L | |
| жіЁж„ҸдәӢйЎ№ | дёҚеҸҜдёҺе…¶д»–жҙ—ж¶ӨеүӮжҲ–ж¶ҲжҜ’ж¶Іж··еҗҲдҪҝз”Ё | |
| з”Ёжі•з”ЁйҮҸ | зЁҖйҮҠеҗҺжөёжіЎжҲ–жҙ—еҲ·зҷҪиүІиЎЈзү©пјҢжөҙзјёзӯү 1 пјҡ 200 ж°ҙжә¶ж¶ІйӨҗйҘ®е…·пјҢз“ңжһңзӯү 1 пјҡ 100 ж°ҙжә¶ж¶І |
(1) вҖң 84 вҖқж¶ҲжҜ’ж¶Ізҡ„жңүж•Ҳж°ҜжҢҮзҡ„жҳҜжҜҸеҚҮеҗ«ж°Ҝж¶ҲжҜ’еүӮзҡ„ж°§еҢ–иғҪеҠӣ ( еҫ—еӨұз”өеӯҗж•° ) зӣёеҪ“дәҺеӨҡе°‘е…Ӣ Cl 2 зҡ„ж°§еҢ–иғҪеҠӣ (Cl еқҮиҪ¬еҢ–дёә Cl - ) гҖӮиӢҘиҜҘ вҖң 84 вҖқж¶ҲжҜ’ж¶Іе•Ҷе“Ғзҡ„жңүж•Ҳж°ҜжҢү 53.25g/L и®Ўз®—пјҢиҜҘж¶ҲжҜ’ж¶Ізҡ„ NaClO зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰжҳҜ _______ гҖӮ
(2) еёёжё©дёӢз”Ёзғ§зўұжә¶ж¶Іеҗёж”¶ Cl 2 еҲ¶еӨҮ вҖң 84 вҖқж¶ҲжҜ’ж¶ІгҖӮеҶҷеҮәиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ _______ пјҢиӢҘе°Ҷ Cl 2 йҖҡе…Ҙзғӯзҡ„зғ§зўұжә¶ж¶ІдёӯпјҢеҸҜд»Ҙеҫ—еҲ° NaCl гҖҒ NaClO е’Ң NaClO 3 зҡ„ж··еҗҲж¶ІгҖӮеҪ“ж··еҗҲж¶Ідёӯ Cl - е’Ң ClO 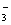
(3) 家еәӯз”Ё вҖң 84 вҖқж¶ҲжҜ’ж¶Із”Ёжі•ејәи°ғпјҢеҒҡ家еәӯзү©е“Ғж¶ҲжҜ’ж—¶пјҢиҰҒеҒҡйҖӮеҪ“зҡ„зЁҖйҮҠпјҢе–·жҙ’еҗҺд№ҹдёҚиҰҒжҖҘдәҺз”Ёжё…ж°ҙж“ҰжӢӯпјҢиҰҒжөёжіЎпјҢиҝҷж ·ж•ҲжһңдјҡжӣҙеҘҪпјҢеҺҹеӣ жҳҜ ______ ( з”ЁзҰ»еӯҗж–№зЁӢејҸиЎЁиҫҫ ) гҖӮ ( е·ІзҹҘпјҡй…ёжҖ§пјҡ H 2 CO 3 >HClO>HCO 
(4) жёёжііжұ ж°ҙзҡ„ж¶ҲжҜ’еӨҡз”ЁжјӮзІүзІҫпјҢдҪҶй…ёзўұжҖ§еҜ№жјӮзІүзІҫзҡ„ж¶ҲжҜ’ж•ҲжһңеҪұе“ҚжҳҺжҳҫгҖӮжұ ж°ҙзўұжҖ§иҝҮејәпјҢжқҖжҜ’дҪңз”Ёдјҡ _______ ( еЎ« вҖң еўһејә вҖқ жҲ– вҖң еҮҸејұ вҖқ) гҖӮ
(5)Cl 2 еҸҜзӣҙжҺҘз”ЁдәҺжқҖиҸҢж¶ҲжҜ’пјҢдҪҶеёёеёёжҠҠж°Ҝж°”еҲ¶жҲҗжјӮзҷҪзІүгҖҒ вҖң 84 вҖқж¶ҲжҜ’ж¶ІпјҢдё»иҰҒзӣ®зҡ„ _____ гҖӮ
A пјҺеўһејәжјӮзҷҪиғҪеҠӣе’Ңж¶ҲжҜ’дҪңз”Ё
B пјҺдҪҝе®ғиҪ¬еҢ–дёәиҫғзЁіе®ҡзү©иҙЁпјҢдҫҝдәҺдҝқеӯҳе’Ңиҝҗиҫ“
C пјҺдҪҝе®ғиҪ¬еҢ–дёәиҫғжҳ“жә¶дәҺж°ҙзҡ„зү©иҙЁ
D пјҺжҸҗй«ҳж°Ҝзҡ„иҙЁйҮҸеҲҶж•°пјҢжңүеҲ©дәҺжјӮзҷҪгҖҒж¶ҲжҜ’
з ”з©¶иЎЁжҳҺ CO дёҺ N 2 O еңЁ Fe + дҪңз”ЁдёӢеҸ‘з”ҹеҸҚеә”зҡ„иғҪйҮҸеҸҳеҢ–еҸҠеҸҚеә”еҺҶзЁӢеҰӮеӣҫжүҖзӨәпјҢдёӨжӯҘеҸҚеә”еҲҶеҲ«дёәпјҡ в‘ N 2 O+Fe + =N 2 +FeO + ( ж…ў ) гҖҒ в‘Ў FeO + +CO=CO 2 +Fe + ( еҝ« ) гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
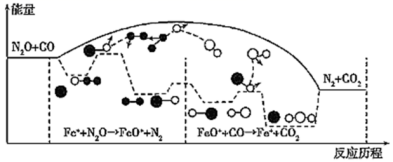
A пјҺ еҸҚеә” в‘ жҳҜж°§еҢ–иҝҳеҺҹеҸҚеә”пјҢеҸҚеә”в‘ЎжҳҜйқһж°§еҢ–иҝҳеҺҹеҸҚеә”
B пјҺ еҚҮй«ҳжё©еәҰпјҢжҖ»еҸҚеә”зҡ„е№іиЎЎеёёж•° K еҮҸе°‘
C пјҺ Fe + дҪҝеҸҚеә”зҡ„жҙ»еҢ–иғҪеҮҸе°ҸпјҢ FeO + жҳҜдёӯй—ҙдә§зү©
D пјҺ иӢҘиҪ¬з§» 1mol з”өеӯҗпјҢеҲҷж¶ҲиҖ—ж ҮеҶөдёӢ 22.4LN 2 O
зҹӯе‘Ёжңҹе…ғзҙ зҡ„зҰ»еӯҗ aA 2 + гҖҒ bB + гҖҒ cC 3 - гҖҒ dD - йғҪе…·жңүзӣёеҗҢзҡ„з”өеӯҗеұӮз»“жһ„пјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ
A пјҺ еҺҹеӯҗеҚҠеҫ„пјҡ A пјһ B пјһ D пјһ C B пјҺ еҺҹеӯҗеәҸж•°пјҡ d пјһ c пјһ b пјһ a
C пјҺ зҰ»еӯҗеҚҠеҫ„пјҡ C пјһ D пјһ B пјһ A D пјҺ еҚ•иҙЁзҡ„иҝҳеҺҹжҖ§пјҡ A пјһ B пјһ D пјһ C
жҹҗж ЎеҢ–еӯҰз ”з©¶жҖ§еӯҰд№ е°Ҹз»„зҡ„еҗҢеӯҰеңЁеӯҰд№ дәҶж°Ёзҡ„жҖ§иҙЁеҗҺи®Ёи®әпјҡиҝҗз”Ёзұ»жҜ”зҡ„жҖқжғіпјҢ既然氨气具жңүиҝҳеҺҹжҖ§пјҢиғҪеҗҰиұЎH2йӮЈж ·иҝҳеҺҹCuOе‘ўпјҹ他们и®ҫи®Ўе®һйӘҢеҲ¶еҸ–氨气并жҺўз©¶дёҠиҝ°й—®йўҳгҖӮиҜ·дҪ еҸӮдёҺжҙ»еҠЁе№¶е®ҢжҲҗдёӢеҲ—з ”з©¶пјҡ
пјҲдёҖпјүеҲ¶еҸ–ж°Ёж°”
пјҲ1пјүе®һйӘҢе®ӨеҲ¶еӨҮж°Ёж°”пјҢдёӢеҲ—ж–№жі•дёӯйҖӮе®ңйҖүз”Ёзҡ„жҳҜВ В В В В В В В В В В В пјҲеЎ«зј–еҸ·пјү
в‘ В ж°ҜеҢ–й“өжә¶ж¶ІдёҺж°ўж°§еҢ–й’ жә¶ж¶Іе…ұзғӯпјӣВ В В В в‘Ў еӣәдҪ“ж°ўж°§еҢ–й’ дёӯж»ҙеҠ жө“ж°Ёж°ҙпјӣ
в‘ўВ еӣәжҖҒж°ҜеҢ–й“өеҠ зғӯеҲҶи§ЈпјӣВ В В В В В В В В В В В В В в‘ЈВ еӣәжҖҒзЎқй…ёй“өеҠ зғӯеҲҶи§ЈпјӣВ В В В В В В ![]() В
В
пјҲ2пјүеҶҷеҮәе®һйӘҢе®ӨеҲ¶еҸ–ж°Ёж°”зҡ„еҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
пјҲдәҢпјүе®һйӘҢжҺўз©¶
иҜҘе°Ҹз»„жҲҗе‘ҳи®ҫи®Ўе®һйӘҢжҺўз©¶ж°Ёж°”иҝҳеҺҹжҖ§еҸҠдә§зү©пјҢжҸҗдҫӣе®һйӘҢиЈ…зҪ®еҰӮдёӢпјҡ
 |
пјҲ3пјүиҜ·дҪ ж №жҚ®жҸҗдҫӣзҡ„иЈ…зҪ®д»Һе·ҰиҮіеҸіиҝһжҺҘжҺҘеҸЈеәҸеҸ·пјҲВ В В пјүпјҲВ В В пјүпјҲВ В В пјүпјҲВ В В пјүпјҲВ В В пјү(В В В )
пјҲ4пјүиҜҘиЈ…зҪ®еңЁи®ҫи®ЎдёҠжңүдёҖе®ҡзҡ„зјәйҷ·пјҢдёәзЎ®дҝқе®һйӘҢз»“жһңзҡ„еҮҶзЎ®жҖ§пјҢдҪ еҜ№иҜҘиЈ…зҪ®зҡ„ж”№иҝӣ![]() жҺӘж–ҪжҳҜ
жҺӘж–ҪжҳҜ
В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
пјҲ5пјүеҲ©з”Ёж”№иҝӣеҗҺзҡ„иЈ…зҪ®иҝӣиЎҢе®һйӘҢпјҢи§ӮеҜҹеҲ°CuOе…ЁйғЁеҸҳдёәзәўиүІзү©иҙЁпјҢж— ж°ҙCuSO4еҸҳи“қпјҢеҗҢж—¶з”ҹжҲҗдёҖз§Қж— жұЎжҹ“зҡ„ж°”дҪ“гҖӮиҜ·еҶҷеҮәNH3дёҺCuOеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В ![]() В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
пјҲ6пјүиЈ…зҪ®Bзҡ„дҪңз”ЁжҳҜпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
пјҲдёүпјүжҸҗеҮә并解еҶій—®йўҳ
пјҲ7пјүжңүеҗҢеӯҰи®ӨдёәпјҡNH3дёҺCuOеҸҚеә”з”ҹжҲҗзҡ„зәўиүІзү©иҙЁдёӯеҸҜиғҪеҗ«жңүCu2OгҖӮе·ІзҹҘCu2OжҳҜзәў![]() иүІзІүжң«пјҢжҳҜдёҖз§ҚзўұжҖ§ж°§еҢ–зү©пјҢеңЁй…ёжҖ§жә¶ж¶ІдёӯпјҢCu+иғҪиҮӘиә«еҸ‘з”ҹж°§еҢ–иҝҳеҺҹеҸҚеә”гҖӮиҜ·дҪ и®ҫи®ЎдёҖдёӘз®ҖеҚ•зҡ„е®һйӘҢжЈҖйӘҢиҜҘзәўиүІзү©иҙЁдёӯжҳҜеҗҰеҗ«жңүCu2OпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В
иүІзІүжң«пјҢжҳҜдёҖз§ҚзўұжҖ§ж°§еҢ–зү©пјҢеңЁй…ёжҖ§жә¶ж¶ІдёӯпјҢCu+иғҪиҮӘиә«еҸ‘з”ҹж°§еҢ–иҝҳеҺҹеҸҚеә”гҖӮиҜ·дҪ и®ҫи®ЎдёҖдёӘз®ҖеҚ•зҡ„е®һйӘҢжЈҖйӘҢиҜҘзәўиүІзү©иҙЁдёӯжҳҜеҗҰеҗ«жңүCu2OпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В
В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В
В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
гҖҗеҢ–еӯҰвҖ”вҖ”йҖүдҝ®зү©иҙЁз»“жһ„дёҺжҖ§иҙЁгҖ‘
XгҖҒYгҖҒZгҖҒMгҖҒNгҖҒQдёәе…ғзҙ е‘ЁжңҹиЎЁеүҚеӣӣе‘Ёжңҹзҡ„е…ӯз§Қе…ғзҙ гҖӮе…¶дёӯпјҢXеҺҹеӯҗж ёеӨ–зҡ„MеұӮдёӯеҸӘжңүдёӨеҜ№жҲҗеҜ№з”өеӯҗпјҢYеҺҹеӯҗж ёеӨ–зҡ„LеұӮз”өеӯҗж•°жҳҜKеұӮзҡ„дёӨеҖҚпјҢZжҳҜең°еЈіеҶ…еҗ«йҮҸпјҲиҙЁйҮҸеҲҶж•°пјүжңҖй«ҳзҡ„е…ғзҙ пјҢMзҡ„еҶ…еұӮз”өеӯҗж•°жҳҜжңҖеӨ–еұӮз”өеӯҗж•°зҡ„9еҖҚпјҢNзҡ„еҺҹеӯҗеәҸж•°жҜ”Mе°Ҹ1, QеңЁе…ғзҙ е‘ЁжңҹиЎЁзҡ„еҗ„е…ғзҙ дёӯз”өиҙҹжҖ§жңҖеӨ§гҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
пјҲ1пјүXе…ғзҙ еңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®жҳҜВ В В В В В В В В В В В В пјҢеұһдәҺВ В В В В В еҢәе…ғзҙ пјҢе®ғзҡ„еӨ–еӣҙз”өеӯҗзҡ„з”өеӯҗжҺ’еёғеӣҫдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
пјҲ2пјүXZ2еҲҶеӯҗзҡ„з«ӢдҪ“з»“жһ„жҳҜВ В В В В В В В пјҢYZ2еҲҶеӯҗдёӯYзҡ„жқӮеҢ–иҪЁйҒ“зұ»еһӢдёәВ В В В В В В В В пјҢзӣёеҗҢжқЎд»¶дёӢдёӨиҖ…еңЁж°ҙдёӯзҡ„жә¶и§ЈеәҰиҫғеӨ§зҡ„жҳҜВ В В В В В В В В пјҲеҶҷеҲҶеӯҗејҸпјүпјҢзҗҶз”ұжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ

пјҲ3пјүеҗ«жңүе…ғзҙ Nзҡ„зӣҗзҡ„з„°иүІеҸҚеә”дёәВ В В В иүІпјҢ
и®ёеӨҡйҮ‘еұһзӣҗйғҪеҸҜд»ҘеҸ‘з”ҹз„°иүІеҸҚеә”пјҢе…¶еҺҹеӣ жҳҜ
В В В В В В В В В В В В В В В В В В В В В .
пјҲ4пјүе…ғзҙ MдёҺе…ғзҙ QеҪўжҲҗжҷ¶дҪ“з»“жһ„еҰӮеӣҫжүҖзӨәпјҢ
и®ҫе…¶жҷ¶иғһиҫ№й•ҝдёәa pmпјҢеҲҷaдҪҚзҪ®дёҺbдҪҚзҪ®д№Ӣй—ҙзҡ„и·қ
зҰ»дёә_______pmпјҲеҸӘиҰҒжұӮеҲ—з®—ејҸпјүгҖӮ






