沙洋县2018年九年级前半期化学期中考试试卷带答案和解析
| 1. 选择题 | 详细信息 |
|
下列变化中,属于化学变化的是( ) A. 汽油挥发 B. 车胎爆炸 C. 铁生锈 D. 液化空气 |
|
| 2. 选择题 | 详细信息 |
|
某同学用分子的观点解释下列现象。其中错误的是( ) A. 热胀冷缩──分子大小随温度的变化而改变 B. 花香四溢──分子不停地运动 C. 食物腐败──分子本身发生了变化 D. 气体易压缩──分子间间隔较大 |
|
| 3. 选择题 | 详细信息 |
|
下列变化过程一定发生化学反应的是: A. 吸附 B. 变色 C. 爆炸 D. 燃烧 |
|
| 4. 选择题 | 详细信息 |
|
逻辑推理是学习化学中常用的方法,下列推理不正确的是( ) A. 化合物是由不同种元素组成的,不同种元素组成的纯净物一定是化合物 B. 不同种分子构成的物质是混合物,混合物一定由不同种分子构成 C. 单质由同一种元素组成,由同一种元素组成的纯净物一定是单质 D. 氧化物只含两种元素,所以含两种元素且有一种元素是氧元素的纯净物一定是氧化物 |
|
| 5. 选择题 | 详细信息 |
|
把下列物质按氯元素的化合价从低到高的顺序排列正确的是( ) ①Cl2;②HClO;③ClO2;④KClO3 ⑤HCl A. ⑤①②③④ B. ⑤③①②④ C. ⑤④③②① D. ⑤②③④① |
|
| 6. 选择题 | 详细信息 |
|
今年,台风“山竹”对我国造成重大影响,部分地区饮用水被污染,为确保灾民的生活用水安全,急需对水进行净化处理,下列措施中,不属于净水方法的是: A. 吸附沉淀 B. 过滤 C. 静置沉淀 D. 加肥皂水 |
|
| 7. 选择题 | 详细信息 |
|
下列防止水污染的措施中,你认为合理的是: ①禁止使用农药和洗衣粉 ②工业废水经处理达标后再排放 ③抑制水中所有动植物的生长 ④生活污水净化后再排放 A. ②④ B. ②③ C. ①④ D. ①③ |
|
| 8. 选择题 | 详细信息 |
|
按照物质分类及化合价规律排列的:Mn、S、MnO2、SO2、K2MnO4、 A.H2S B.Na2SO3 C.CuSO4 D.Cu2S |
|
| 9. 选择题 | 详细信息 |
|
硝酸是一种具有强氧化性的酸,它不仅能与活泼金属发生反应,也能与许多不活泼金属发生反应.其中金属铜与稀硝酸反应的化学方程式为:3Cu+8HNO3(稀)= 3Cu(NO3)2+2X↑+4H2O,则X的化学式为: A. NO2 B. NO C. N2O D. N2O4 |
|
| 10. 选择题 | 详细信息 |
图中“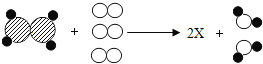 A.物质X是由碳元素和氧元素组成 B.X物质中碳、氧元素的质量比是3:8 C.每个X分子由1个碳原子和2个氧原子构成 D.物质X的相对分子质量是44g |
|
| 11. 选择题 | 详细信息 |
|
在反应A+3B=2C+3D中,C和D的相对分子质量比是22:9.若4.6gA与B完全反应后生成8.8gC,则此反应中B与D的质量比是: A. 16︰9 B. 1︰1 C. 13︰6 D. 44 ︰23 |
|
| 12. 选择题 | 详细信息 |
|
下列燃烧现象的描述中,正确的是( ) A. 蜡烛在空气中燃烧时,有水和二氧化碳生成 B. 木炭在氧气中燃烧时,有黑色固体生成 C. 红磷点燃后伸入氧气中产生大量白雾 D. 硫粉在氧气中燃烧产生明亮蓝紫色火焰 |
|
| 13. 选择题 | 详细信息 | |||||||||||||||
在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下反应一段时间后,测得反应前后各物质质量如下表:
|
||||||||||||||||
| 14. 选择题 | 详细信息 |
化学概念相互间存在如右图3种关系:  下列对概念间关系的说法正确的是 ( ) A. 纯净物与混合物属于包含关系 B. 化合物与氧化物属于包含关系 C. 单质与化合物属于交叉关系 D. 氧化反应与化合反应属于并列关系 |
|
| 15. 选择题 | 详细信息 |
|
下列各组微粒中,属于同一种元素的是 A.Cl和Cl C.H和He D.  |
|
| 16. 选择题 | 详细信息 |
|
将硅粉与镁粉混合后隔绝空气强热,得到一种暗蓝色的化合物。将此化合物投入水中,发生剧烈反应,产生气体,并伴有爆炸声与火光。此过程不可能发生的反应是 A.2Mg + Si高温 Mg2Si B.Mg2Si + 4H2O = 2Mg(OH)2 + SiH4↑ C.SiO2 + H2O = H2SiO3 D.SiH4 + 2O2 = SiO2 + 2H2O |
|
| 17. 选择题 | 详细信息 |
|
我国“化学”一词最早出于《化学鉴原》(1871年)。该书把一种元素翻译为“矽(xi)”。在地壳里,“矽”的含量在所有元素含量中占第二位,现代把这种“矽”元素命名为 A. 锡 B. 硒 C. 氧 D. 硅 |
|
| 18. 选择题 | 详细信息 |
|
下列物质的名称与化学式相符的是 A. 硫酸铁(FeSO4) B. 生石灰(CaO) C. 氯酸钾(KCl) D. 氧化铁(Fe3O4) |
|
| 19. 选择题 | 详细信息 | ||||||||||||||||||||
鉴别日常生活中的下列各组物质,操作1和操作2均有错误的是
|
|||||||||||||||||||||
| 20. 填空题 | 详细信息 |
|
用化学用语填空: ①氦气_____ ②水_____ ③两个亚铁离子_____ ④硫酸铜_____ ⑤两个硝酸根离子____;⑥2个氮分子_____;⑦保持一氧化碳化学性质的最小微粒______;⑧氧化镁中镁显+2价______。 |
|
| 21. 填空题 | 详细信息 |
| 写出下列符号中“2”的意义:2O2______________、_______________: | |
| 22. 填空题 | 详细信息 |
| 以下物质:①氮气;②稀有气体;③液氧;④汽水;⑤二氧化碳;⑥新鲜的空气;⑦冰水混合物;⑧澄清石灰水;⑨高锰酸钾受热分解以后的剩余固体;⑩高锰酸钾完全分解以后的剩余固体。其中属于混合物的是(填序号)______ 。 | |
| 23. 填空题 | 详细信息 |
|
根据题意书写化学方程式: (1)用赤铁矿(主要成分为氧化铁)和一氧化碳反应炼铁,同时生成二氧化碳;____ (2)天然气(主要成分为CH4)在空气中燃烧生成水和二氧化碳。____________ |
|
| 24. 填空题 | 详细信息 |
|
阅读材料,回答问题: 材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表,并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素。 材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g·cm-3,能与沸水剧烈反应生成氢气和氢氧化镓。不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0 g·cm-3之间。 材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g·cm-3,从而验证了元素周期表的正确性。随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素。目前金属镓广泛用于制造半导体材料。镓的原子结构示意图如图,常见化合价为+3。  (1)镓元素的质子数为_____,其原子最外层电子数为_______; (2)请根据上述材料,写出氢氧化镓的化学式______ |
|
| 25. 填空题 | 详细信息 | ||||||||||||||||||||||||
我们周围的物质世界是由100多种元素组成的,为了便于研究元素的性质,常常需要寻找它们之间的内在规律。下表列出的是1~18号元素的部分最高正化合价和最低负化合价。请阅读并回答下列问题:
|
|||||||||||||||||||||||||
| 26. 推断题 | 详细信息 |
A~G是初中常见的7种物质,它们有如下图所示的转化关系(部分产物已略去)。已知A、C是无色液体,B、F是无色气体,其中大量排放F会引起温室效应,D是黑色固体,G是暗紫色固体。 (1)请写出下列物质的化学式: A_____;H_________ 。 (2)请写出化学反应方程式:B→F_______________、G→B_____________。 (3)实验室常用_________检验B气体。 |
|
| 27. 实验探究题 | 详细信息 |
实验室制取气体所需装置如下图所示,请回答以下问题:  (1)仪器①④的名称分别是________和___________。 (2)实验室用过氧化氢溶液和二氧化锰制取氧气,所选用的气体发生装置是(填字母序号)_____,反应的化学方程式为_________;如果要制得较干燥的氧气最好应该选择装置_____收集,其验满的方法:__________。 (3)实验室还常用块状固体硫化亚铁(FeS)和稀硫酸在常温下制取硫化氢气体,硫化氢气体是一种有臭鸡蛋气味的有毒的气体,能溶于水,密度比空气大。根据上述信息回答:实验室制取硫化氢的发生装置为_____,收集装置为_______;(填字母序号)实验室选用上图所示的E装置收集硫化氢气体,气体应该从____(填“a”或“b”)端进入。 |
|
| 28. 计算题 | 详细信息 |
|
2015年10月5日,中国宁波籍科学家屠呦呦因发现青蒿素(化学式为C15H22O5,一种用于治疗疟疾的药物)而获得诺贝尔生理学和医学奖。青蒿素的发现挽救了全球特别是发展中国家数百万人的生命。试计算: (1)青蒿素的相对分子质量___________; (2)青蒿素中C、H、O元素的质量比_______; (3)青蒿素中碳元素的质量分数___________。 |
|
| 29. 计算题 | 详细信息 |
|
紫钰同学为了测定实验室中某氯酸钾的纯度,取5g该样品与1g二氧化锰混合,加热到不再产生气体为止,称量剩余固体的质量为4.08g,求: (1)完全反应后产生氧气的质量为_____g; (2)求样品中氯酸钾的质量分数(纯度)________。 |
|
最近更新



