师范大学附属中学2018年高一化学下册期中考试同步练习
| 1. 选择题 | 详细信息 |
|
下列有关化学用语表示正确的是 A. H2O2的电子式:H+[∶ B. Cl-的结构示意图: C. 原子核中有10个中子的氧离子: D. HClO的结构式:H—Cl—O |
|
| 2. 选择题 | 详细信息 |
|
常用的相对原子质量如S~32 Cl~35.5 Cu~64等,这些数值准确地说应该是 A. 某种核素的相对原子质量 B. 某种核素的近似相对原子质量 C. 某种元素的平均相对原子质量 D. 某种元素的平均相对原子质量的近似值 |
|
| 3. 选择题 | 详细信息 |
|
下列过程中,共价键被破坏的是 A. 碘升华 B. 冰融化成水 C. 葡萄糖溶于水 D. HCl气体溶于水 |
|
| 4. 选择题 | 详细信息 | ||||||||
NF3是一种温室气体,其存储能量能力是CO2的12000〜20000倍,在大气中的寿命可长达740年,如表所示是几种化学键的键能,下列说法中正确的是
|
|||||||||
| 5. 选择题 | 详细信息 |
LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是 A. a处通入氧气, b处通氢气 B. 通入H2的电极发生反应:H2-2e- = 2H+ C. 通入O2的电极发生反应:O2 + 4e- + 2H2O = 4OH- D. 该装置将化学能最终转化为电能 |
|
| 6. 选择题 | 详细信息 |
|
已知稀溶液中H+(aq)+OH-(aq)===H2O(l),生成1 mol H2O(l)放出57.3 kJ 热量。下列过程中放出热量为57.3 kJ的是 A. 1 mol H2SO4与足量的NaOH溶液反应 B. 稀盐酸与氨水反应生成1 mol H2O(l) C. 稀盐酸与稀Ba(OH)2溶液反应生成1 mol H2O(l) D. 稀NaOH与98%浓硫酸反应生成 1 mol H2O(l) |
|
| 7. 选择题 | 详细信息 |
|
定容容器中发生反应I2(g)+H2(g) A. 升高温度 B. 使用催化剂 C. 充入稀有气体,增大体系压强 D. 增加I2和H2的起始量 |
|
| 8. 选择题 | 详细信息 |
|
对于反应4NH3+5O2=4NO+6H2O,下列为4种不同情况下测得的反应速率中,表明该反应进行最快的是 A、v(NH3)=0.2 mol/(L·s) B、v(O2)=1.4 mol/(L·min) C、v(H2O)=0.25 mol/(L·s) D、v(NO)=9 mol/(L·min) |
|
| 9. 选择题 | 详细信息 |
|
下列各分子中,所有原子都满足最外层为8电子结构的是 A. BeCl2 B. H2S C. PCl5 D. N2 |
|
| 10. 选择题 | 详细信息 |
|
下列是四种烷烃分子的球棍模型或结构简式,其中沸点最高的是 A. 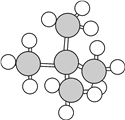 B. CH3CH2CH2CH2CH2CH3 B. CH3CH2CH2CH2CH2CH3C. CH3CH2CH2CH2CH3 D. CH3CH2CH3 |
|
| 11. 选择题 | 详细信息 |
|
既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的少量乙烯的操作方法是( ) A. 混合气体通过盛水的洗气瓶 B. 混合气体通过装有过量溴水的洗气瓶 C. 混合气体和过量H2混合 D. 混合气体通过酸性KMnO4溶液 |
|
| 12. 选择题 | 详细信息 |
下列关于苯的叙述正确的是 A. 反应①为取代反应,有机产物与水混合浮在上层 B. 反应②为氧化反应,反应现象是火焰明亮并带有浓烟 C. 反应③为取代反应,有机产物是一种烃 D. 反应④中1 mol苯最多与3 mol H2发生加成反应,因为每个苯分子含有三个碳碳双键 |
|
| 13. 选择题 | 详细信息 |
图片是立方烷(cunane)的球棍模型,下列有关说法不正确的是( ) A. 其一氯代物只有一种 B. 其二氯代物有三种同分异构体 C. 常温下为气体 D. 它与苯乙烯(C6H5—CH===CH2)互为同分异构体 |
|
| 14. 选择题 | 详细信息 |
|
使1 mol乙烯与氯气完全发生加成反应,然后使该加成反应的产物与氯气在光照条件下发生完全取代反应,则两个过程中消耗氯气的总物质的量是 A. 3 mol B. 4 mol C. 5 mol D. 6 mol |
|
| 15. 填空题 | 详细信息 |
|
有下列各组物质:① ④正丁烷和异庚烷;⑤乙烯和聚乙烯;⑥  ;⑦丙烷和环丙烷 ;⑦丙烷和环丙烷 ⑧CH3-CH2-CH2-CH3 和CH3-CH(CH3)CH3。用序号填空: (1)____________组两者互为同位素。 (2)____________组两者互为同素异形体。 (3)____________组两者属于同系物。 (4)____________组两者互为同分异构体。 (5)____________组两者是同一物质。 |
|
| 16. 综合题 | 详细信息 | ||||||||||||||||||||||||||||||||||||
下表是元素周期表的一部分,请回答有关问题:
|
|||||||||||||||||||||||||||||||||||||
| 17. 填空题 | 详细信息 | ||||||||||||||||||||
某化学反应中,设反应物的总能量为E1,生成物的总能量为E2, (1)若E1>E2,则该反应为_____________(填“放热”或“吸热”)反应。该反应可用图_____________(填“A”或“B”)表示。 (2)若E1<E2,则该反应为_____________(填“放热”或“吸热”)反应。该反应可用图___________(填“A”或“B”)表示 (3)太阳能的开发和利用是21世纪的一个重要课题。 ①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节。已知下列数据:
|
|||||||||||||||||||||
| 18. 填空题 | 详细信息 |
某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。 (1)请写出该反应的化学方程式:_____________________________。 (2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。 A.容器内各气体组分的质量分数不再发生改变 B.正反应速率与逆反应速率相等 C.容器内气体的密度不再发生改变 D.混合气体的平均相对分子质量不再发生改变 |
|
| 19. 填空题 | 详细信息 |
如下图所示是由4个碳原子结合成的4种烃(氢原子没有画出)。 (1)写出有机物(a)的习惯命名法的名称:________。 (2)上述有机物中,分子中碳原子一定在同一平面的是______________、______________(填结构简式)。 (3)上述有机物中不能与溴水发生反应使其褪色的有______(填字母代号)。 |
|
| 20. 实验题 | 详细信息 |
下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。 (1)A中碎瓷片的作用是____________。 (2)乙烯的电子式为__________________。 (3)下列物质中,可以通过乙烯的加成反应得到的是______(填字母代号)。 A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br (4)运输水果时,为了吸收水果产生的乙烯,防止水果早熟腐烂,常将浸泡有_______溶液的硅藻土放置在盛放水果的容器中。 |
|
| 21. 选择题 | 详细信息 |
在下列各图曲线中分别表示物质的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),下列选项中的对应关系错误的是 A. 图①可以表示F-、Na+、Mg2+、Al3+四种离子的离子半径大小关系 B. 图②可以表示ⅡA族元素的最外层电子数 C. 图③可以表示ⅥA族元素氢化物的沸点高低关系 D. 图④可以表示第三周期中的非金属元素对应单质的熔点高低关系 |
|
| 22. 选择题 | 详细信息 |
肼(N2H4)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示。肼能与双氧水发生反应N2H4+2H2O2===N2+4H2O,用NA表示阿伏加德罗常数的值。下列说法正确的是 A. 标准状况下,11.2 L N2中含有的电子总数为5NA B. 标准状况下,22.4 L N2H4中含有的原子总数为6NA C. 标准状况下,3.2 g N2H4中含有共价键的总数为0.6NA D. 若生成3.6 g H2O,则上述反应转移电子的数目为0.2NA |
|
| 23. 选择题 | 详细信息 |
化合物Bilirubin 在一定波长光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4〜8min 平均反应速率和推测反应 16min 时反应物的浓度,结果应是 A. 2.5μmol/(L·min)和 2.0μmol B. 2.5μmol/(L·min)和 2.5μmol C. 3.0μmol/(L·min)和 3.0μmol D. 5.0μmol/(L·min)和 3.0μmol |
|
| 24. 选择题 | 详细信息 |
|
X、Y、Z三种气体,取X和Y按1︰1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y A. 33% B. 40% C. 50% D. 66% |
|
| 25. 选择题 | 详细信息 |
|
某烯烃 A. 1种 B. 2种 C. 3种 D. 4种 |
|
| 26. 综合题 | 详细信息 | |||||||||||||||||||||
X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下表所示:
|
||||||||||||||||||||||
| 27. 实验题 | 详细信息 |
某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题: (1)实验开始时,关闭K2、开启K1和分液漏斗活寒,滴加苯和液溴的混合液,反应开始。装置II中生成有机物的反应为__________(填化学方程式),装置III中小试管内苯的作用是__________。 (2)能说明苯与液溴发生了取代反应的现象是__________。 (3)反应结束后,要让装置I中的水倒吸入装置II中。这样操作的目的是__________,简述这一操作的方法:______________________________。 (4)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。 ①用蒸馏水洗涤,振荡,分液; ②用5%的溶液洗涤,振荡,分液; ③用蒸馏水洗涤,振荡,分液; ④加入无水CaCl2粉末干燥; ⑤__________(填操作名称). |
|






