2019-2020年高一上半期期中联考化学题免费试卷(天津市六校)
| 1. 选择题 | 详细信息 |
|
下列有关物质分类或归类正确的一组是 ①液氯、干冰、氯化银均为化合物 ②氯水、盐酸、稀硫酸均为混合物 ③胆矾、小苏打、次氯酸钠均为电解质 ④牛奶、豆浆、石灰水均为胶体 ⑤Na2O、Na2CO3、Na2SiO3均为钠盐 A.①② B.②③ C.③④ D.②③⑤ |
|
| 2. 选择题 | 详细信息 |
|
苹果汁是人们喜爱的饮料。由于饮料中含有Fe2+离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,使Fe2+转变为Fe3+离子。若榨苹果汁时加入维生素C,会有效防止这种现象的发生。这说明维生素C具有 A. 氧化性 B. 还原性 C. 酸性 D. 碱性 |
|
| 3. 选择题 | 详细信息 |
|
分类是化学学习中经常用到的方法,下列对物质或化学反应的分类及依据正确的是 A.NaHSO4在水中能电离出H+,所以NaHSO4属于酸 B.Na和H2O的反应不是离子反应,因为反应中没有离子参加 C.豆浆是胶体,因为豆浆中的分散质粒子直径在1~100nm之间 D.Na在Cl2中燃烧不是氧化还原反应,因为没有得氧或失氧 |
|
| 4. 选择题 | 详细信息 |
|
下列化学反应的离子方程式正确的是 A.往碳酸氢钠溶液中滴加氢氧化钠溶液:HCO3-+OH-=CO2↑+H2O B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O C.铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
|
| 5. 选择题 | 详细信息 |
|
下列描述正确的是 A.烧碱固体、纯醋酸、乙醇均不导电,所以他们都不是电解质 B.Na2O、Na2O2、CaO都能溶于水生成碱,它们都属于碱性氧化物 C.同素异形体由同种元素组成,所以同素异形体之间的转化为物理变化 D.可使用丁达尔效应来区分FeCl3溶液和Fe(OH)3胶体 |
|
| 6. 选择题 | 详细信息 |
|
关于氧化还原反应,下列说法正确的是( ) ①氧化剂发生氧化反应 ②氧化剂具有氧化性 ③某元素在反应中由化合物转化为单质,该元素一定被氧化 ④物质所含元素化合价变化是判断氧化还原反应的依据 ⑤失电子越多的还原剂,其还原性越强 A.①②④ B.②③④ C.②④ D.②④⑤ |
|
| 7. 选择题 | 详细信息 |
|
下列溶液中,能大量共存的离子组是 A. 遇酚酞试剂变红的溶液:K+、Cu2+、NO3-、SO42- B. 遇紫色石蕊试剂变红的溶液:K+、Na+、Cl-、CO32- C. 常温下pH<7的溶液:Ba2+、NH4+、NO3-、Cl- D. 无色透明溶液中:K+、Na+、MnO4-、SO42- |
|
| 8. 选择题 | 详细信息 |
|
下列有关叙述正确的是 A.现有CO、CO2、O3三种气体,它们都含有1molO,则三种气体的物质的量之比为3:2:1 B.相同条件下,同体积、同密度的C2H4和N2,两种气体的分子数一定相等 C.28gCO和22.4LCO2中含有的碳原子数一定相等 D.配制450mL0.1mol·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8g |
|
| 9. 选择题 | 详细信息 |
|
下列化学反应的实验现象及结论描述正确的是 A.钠在空气中燃烧发出黄色火焰,生成氧化钠 B.钠加入到CuSO4溶液中,有红色物质析出,即析出Cu单质 C.向CaCl2溶液中通入少量CO2气体,出现白色沉淀,即生成CaCO3固体 D.氢气在氯气中燃烧产生苍白色火焰,生成了HCl气体 |
|
| 10. 选择题 | 详细信息 |
|
100mL0.10mol·L-1Na2SO3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则SO32-将转化为 A.SO42- B.S C.SO2 D.S2- |
|
| 11. 选择题 | 详细信息 |
|
在常温下,发生下列几种反应: ①16H++10Z-+2XO4-=2X2++5Z2+8H2O ②2A2++B2=2A3++2B- ③2B-+Z2=B2+2Z- 根据上述反应,判断下列结论中错误的是 A.溶液中可发生反应:Z2+2A2+=2A3++2Z- B.氧化性强弱的顺序为XO4->Z2>B2>A3+ C.Z2在①③反应中为还原剂 D.X2+是XO4-的还原产物 |
|
| 12. 选择题 | 详细信息 |
|
下列说法正确的是 A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- B.向等质量的Na2CO3和NaHCO3 固体中分别加入足量盐酸,后者产生的CO2多 C.可用相同的离子方程式表示Na2CO3和NaHCO3分别与硝酸的反应 D.某溶液中加入硝酸银溶液,产生白色沉淀,该溶液中一定含有Cl- |
|
| 13. 选择题 | 详细信息 |
|
下列叙述正确的是 A.用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色,则溶液中有Na+,无K+ B.在Na2O2与水的反应中,氧化产物与还原产物的物质的量之比为1∶4 C.新制氯水中加入有色布条,有色布条褪色,说明氯水中含Cl2 D.相同物质的量的氧化钠和过氧化钠中阴离子的物质的量之比为1∶1 |
|
| 14. 选择题 | 详细信息 |
|
NA代表阿伏加德罗常数的值。下列说法中,正确的是 A.标准状况下,11.2LH2O含有的原子数目为1.5NA B.0.3mol·L-1的Na2SO4溶液中含有Na+和SO42-的数目为0.9NA C.在常温常压下,28gN2与CO混合物气体中所含的分子数目一定为NA D.1L0.45mol·L-1NaCl溶液中Cl-的物质的量浓度比0.1L0.15mol·L-1AlCl3溶液大 |
|
| 15. 选择题 | 详细信息 |
|
下列有关Na2CO3和NaHCO3的性质,叙述错误的是 A.鉴别Na2CO3和NaHCO3可用Ba(OH)2溶液 B.除去Na2CO3固体中混有的少量NaHCO3,用加热法 C.向Na2CO3饱和溶液中通入足量CO2,有NaHCO3晶体析出 D.分别向等浓度的Na2CO3和NaHCO3溶液中滴加酚酞,前者红色更深 |
|
| 16. 选择题 | 详细信息 |
|
在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O,下列叙述中正确的是 A.反应中KMnO4被氧化 B.每生成1molCl2时,反应中转移的电子为2mol C.氧化产物与还原产物的物质的量之比为2:5 D.每消耗16molHCl时,其中作氧化剂的HCl是10mol |
|
| 17. 选择题 | 详细信息 |
向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是( )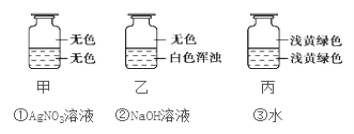 A. ①②③ B. ③②① C. ②①③ D. ①③② |
|
| 18. 选择题 | 详细信息 | |||||||||||||||
某固体混合物可能由Na2CO3、Na2SO4、CuSO4、KCl等混合而成,为检验其组成,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
|
||||||||||||||||
| 19. 计算题 | 详细信息 |
|
完成下列与“物质的量”相关的计算。 (1)标准状况下,33.6LCO2的物质的量为___mol,质量为___g,所含O原子的数目是____个。 (2)同温同压下,同体积的氨(NH3)和硫化氢(H2S)气体的质量之比是____,同质量的氨和硫化氢气体所含氢原子个数之比是___。 (3)agCl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为____。 |
|
| 20. 推断题 | 详细信息 |
|
无色气体A在一种黄绿色气体B中可安静地燃烧,发出苍白色火焰,反应生成气体C。B与金属D反应可生成白色固体E,D在空气中燃烧生成浅黄色固体F,F与CO2反应可得到气体G,D与水反应可生成A,A在G中燃烧生成水。推断出各种物质后,回答下列问题: (1)E的化学式为_____。 (2)由D生成F的化学方程式为:_____。 (3)D与H2O反应的离子方程式为:______。 (4)写出F与CO2反应的化学方程式,并用双线桥表示该反应的电子转移____。 |
|
| 21. 实验题 | 详细信息 |
|
结合所学相关知识,完成以下实验题。 Ⅰ.实验室中盐酸的用途十分广泛,常常用来制备气体 (1)某小组同学欲用4mol/L的盐酸配制230mL0.4mol/L盐酸溶液,需用量筒取用4mol/L盐酸_____mL,实验中需要用到的玻璃仪器有_____、_____、量筒、烧杯、玻璃棒。 (2)下列实验操作使配制的溶液浓度偏低的是_____。 A.容量瓶洗涤后未干燥 B.移液时,有少量溶液溅出 C.定容时,加水不慎超过刻度线,又倒出一些 D.定容时,俯视刻度线 Ⅱ.已知铁屑和氯气在500~600℃下可制取无水FeCl3,如图是制取氯化铁粉末所需的装置,已知氯化铁粉末容易吸水生成结晶化合物:FeCl3+6H2O=FeCl3·6H2O。请回答下列问题。 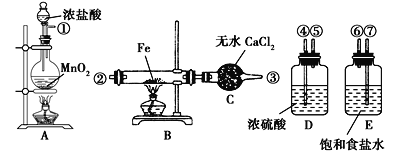 (1)按照气体流向从左到右的顺序连接仪器(填仪器接口):①接____,____接____,____接②。 (2)A装置的烧瓶中发生反应的离子方程式为_____,B装置中发生反应的化学方程式为____。 (3)D装置的作用是_____;E装置的作用是_____。 (4)实验开始时,应先点燃_____(填“A”或“B”)处的酒精灯。 (5)这套实验装置是否完整?____(填“是”或“否”)。若不完整,还须补充__(若第一空填“是”,则此空不需要作答)装置。 (6)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为____。 已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是____(填序号)。 ①CO2 ②HCl ③H2O ④H2 A.①②③ B.②③④ C.②③ D.①④ |
|
最近更新



