西畴县二中高二化学开学考试(2019年上册)同步练习
| 1. 选择题 | 详细信息 |
|
氯化钠溶液含有少量的氯化铁。若要得到纯净的固体氯化钠,可供选择的操作有:①加适量盐酸溶液、②加金属铁粉、③蒸发结晶、④加过量氢氧化钠溶液、⑤冷却热饱和溶液、⑥过滤。正确的操作步骤是( ) A. ②⑥③ B. ④⑥①③ C. ④⑥③⑤ D. ②⑥①③⑤ |
|
| 2. 选择题 | 详细信息 |
|
下列粒子示意图中,表示+2价阳离子的是( ) A. |
|
| 3. 选择题 | 详细信息 |
|
下列说法不正确的是( ) A. 非金属单质氯气、白磷、金刚石等都含有非极性键 B. 化合物氯化氢、硫酸、甲烷中都含有极性键 C. 氧化物二氧化碳、三氧化硫、过氧化钠中都含有共价键 D. 离子化合物中一定不含有共价键 |
|
| 4. 选择题 | 详细信息 |
|
从海水中提取的溴约占世界溴年产量的1/3,从海水中提取溴的主要步骤可表示为( )。 A. 氧化→吸收→吹出 B. 氧化→吹出→吸收 C. 吹出→氧化→吸收 D. 吹出→吸收→氧化 |
|
| 5. 选择题 | 详细信息 |
|
下列有关能源的说法错误的是( )。 A.风能是人类通过风车等工具获取的能源,但属于一次能源 B.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 C.月球土壤中含有丰富的质量数为3的氦,它可作为未来核能的重要原料 D.原电池把化学能直接转化为电能,所以由原电池提供的电能是一次能源 |
|
| 6. 选择题 | 详细信息 |
|
生命起源的研究是世界性科技领域的一大课题,科学家认为生命起源的第一层次是产生了与硝基化合物可能是同分异构体的物质,这类物质是( ) A. 醇 B. 羧酸 C. 糖 D. 氨基酸 |
|
| 7. 选择题 | 详细信息 |
|
“纳米材料”是指微粒直径为几纳米到几十纳米的材料,如将纳米材料作为分散质分散到水中,得到的分散系具有的性质中,不可能有的是( ) A. 一定能透过半透膜 B. 一定能透过滤纸 C. 具有丁达尔效应 D. 有电泳现象 |
|
| 8. 选择题 | 详细信息 |
|
乙烷和乙烯的混合气体200 mL,在催化剂的作用下与氢气发生加成反应,最多消耗氢气100 mL,则原混合气体中乙烷和乙烯的体积比是( ) A. 2∶1 B. 3∶1 C. 1∶1 D. 1∶3 |
|
| 9. 选择题 | 详细信息 |
|
将盛有氮气和二氧化氮(无N2O4)混合气体的试管倒立于水中,经过足够长时间后,试管内气体的体积缩小为原来的一半,则原混合气体中氮气与二氧化氮的体积比是( ) A. 1∶1 B. 1∶2 C. 1∶3 D. 3∶1 |
|
| 10. 选择题 | 详细信息 |
|
有关铝及其化合物的说法错误的是 A. 铁易生锈,而铝在空气中较稳定,所以铁比铝活泼 B. 可用铝壶烧开水,不可用其长期存放食醋、碱水 C. 氧化铝是一种较好的耐火材料,但不可用氧化铝坩埚熔化NaOH D. 氢氧化铝能中和胃酸,可用于制胃药 |
|
| 11. 选择题 | 详细信息 |
|
已知X+结构示意图如下图,则X在元素周期表中的位置是( ) A. 第二周期0族 B. 第四周期ⅠA族 C. 第三周期ⅠA族 D. 第三周期ⅦA族 |
|
| 12. 选择题 | 详细信息 |
|
原电池产生电流的本质原因是( ) A. 电解质溶液中有电离出的自由移动的离子 B. 有导线将两个活泼性不同的电极连接 C. 在不同金属的两极间存在电势差 D. 在原电池中发生了氧化还原反应 |
|
| 13. 选择题 | 详细信息 |
|
在标准状态下,两种气态烷烃混合物的密度是1.16 g·L-1,此混合物组成不可能的是( ) A. 甲烷和乙烷 B. 乙烷和丙烷 C. 甲烷和丙烷 D. 甲烷和丁烷 |
|
| 14. 选择题 | 详细信息 |
|
下列有关试剂的保存方法错误的是( ) A. 氢氧化钠溶液保存在具有玻璃塞的试剂瓶中 B. 少量的钠保存在煤油中 C. 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 D. 浓硝酸保存在棕色玻璃试剂瓶中 |
|
| 15. 选择题 | 详细信息 |
|
无机化学命名委员会在1989年作出决定:把周期表原先的主、副族号取消,由左到右按原顺序编为18列,如碱金属为第1列,稀有气体为第18列。按这个规定,下列说法正确的是( ) A. 每一列都有非金属元素 B. 第3列元素种类最多,第14列的化合物种类最多 C. 从上到下第1列元素的单质熔点逐渐升高,而第17列元素的单质熔点逐渐降低 D. 只有第2列元素的原子最外层有2个电子 |
|
| 16. 选择题 | 详细信息 |
|
下列各微粒中,各个电子层电子数都达到2n2个的是 ( ) A. Ne、Ar B. Al3+、S2- C. F-、Na+ D. Ne、Cl- |
|
| 17. 选择题 | 详细信息 |
|
金属钙的冶炼方法是电解法,这一事实说明了( ) A. 金属钙离子易得电子变成金属钙原子 B. 金属钙是不活泼的金属元素 C. 金属钙原子易失去电子变成钙离子 D. 金属钙离子的氧化性很强 |
|
| 18. 选择题 | 详细信息 |
|
绿色化学提倡化工生产应提高原子利用率,原子利用率表示目标产物的质量与生成物总质量之比。在下列制备环氧乙烷的反应中,原子利用率最高的是 ( ) A. CH2=CH2+Cl2+Ca(OH)2 B. 2CH2=CH2+O2 C.  +HOCH2CH2-O-CH2CH2OH+2 H2O +HOCH2CH2-O-CH2CH2OH+2 H2O |
|
| 19. 选择题 | 详细信息 |
|
下列物质是纯净物的是( ) A. 玻璃 B. 水泥 C. 纯碱 D. 水玻璃 |
|
| 20. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 浓硝酸和浓硫酸都应保存在棕色试剂瓶中 B. 氢氧化钠溶液用带有橡胶塞的试剂瓶保存 C. 工业制得的浓盐酸、浓硝酸所带黄色都是Fe3+所致 D. 铝制或铁制容器可贮运浓硫酸、浓硝酸和浓盐酸这三大强酸 |
|
| 21. 选择题 | 详细信息 |
某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是 A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色 B. 装置C的作用是吸收SO2尾气,防止污染空气 C. 为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去 D. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀 |
|
| 22. 选择题 | 详细信息 |
|
下列说法不正确的是( ) A. 煤矿内瓦斯、煤气、油田气中都含有甲烷 B. 农村沼气池产生的可燃气体是甲烷 C. 煤矿坑气是植物残体经微生物发酵而产生 D. 甲烷是天然气的主要成分 |
|
| 23. 选择题 | 详细信息 |
|
下列混合物分离与提纯操作中不正确的是( ) A. 将浑浊的石灰水过滤可使其变澄清 B. 铜粉和铁粉的混合物可用磁铁进行分离 C. 氯化钠混有少量单质碘可用加热法除去 D. 粗盐经溶解、过滤、蒸发结晶可得到纯净的氯化钠 |
|
| 24. 实验题 | 详细信息 | ||||
|
实验室用密度为1.25 g•mL﹣1、质量分数为36.5%的浓盐酸配制240 mL 0.1 mol•L﹣1的盐酸,请回答下列问题: (1)浓盐酸的物质的量浓度为________________________。 (2)配制240 mL 0.1 mol•L﹣1的盐酸
|
|||||
| 25. 实验题 | 详细信息 |
某实验小组用如图所示装置进行乙醇的催化氧化实验。 (1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是________反应(填“吸热”或“放热”)。 (2)甲和乙两个水浴作用不相同:甲的作用是________;乙的作用是________。 (3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________,集气瓶中收集到的主要成分是____________。 |
|
| 26. 实验题 | 详细信息 |
|
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。 (2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。 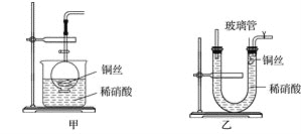 ①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。 A.铁 B.铝 C.铂 D.玻璃 ②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。 (3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。 ①长玻璃管的作用是______________________________________________________。 ②让反应停止的操作方法及原因是__________________________________________。 (4)以下收集NO气体的装置,合理的是________(填序号)。  (5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答: ①NO的体积为________ L,NO2的体积为________ L。 ②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。 |
|
| 27. 实验题 | 详细信息 |
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下: 试回答下列问题: (1)请写出C装置中生成CH3Cl的化学反应方程式:______________________________。 有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法________(填“正确”或 “不正确”)。 (2)B装置有三种功能;①控制气流速度;②混匀混合气体;③________。 (3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有________溶液。 (4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。 A.分液法 B.蒸馏法 C.结晶法 (5)将1molCH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为 ,生成HCl的物质的量共为 。 |
|
| 28. 推断题 | 详细信息 |
A、B是两种有刺激气味的气体。试根据下列实验事实填空。 (1)写出A~F各物质的化学式: A__________、B__________、C__________、D__________、E__________、F__________。 (2)写出A、B跟水反应的离子方程式:______________________。 |
|
| 29. 填空题 | 详细信息 |
|
为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54mol电子。 (1)该融雪剂的化学式是____,该物质中化学键类型是______,电子式是______。 (2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是__________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为_________,电子式为_______,化学键类型为_________(填“离子键”“非极性共价键”或“极性共价键”)。 (3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成____,其化学键类型为___;加热时生成_____,其化学键类型为_______。 |
|
最近更新



