湖南省邵阳市隆回县2020-2021年高一上学期期末考试化学免费试卷完整版
| 1. 选择题 | 详细信息 |
|
容量瓶上不需要标明的是( ) A.温度 B.物质的量浓度 C.规格 D.刻度线 |
|
| 2. 选择题 | 详细信息 |
|
下列物质属于电解质的是( ) A.蔗糖 B.玻璃 C.纯碱 D.铁 |
|
| 3. 选择题 | 详细信息 |
|
当光束通过下列分散系时,能观察到丁达尔效应的是( ) A.Mg(OH)2悬浊液 B.稀盐酸 C.K2SO4溶液 D.Fe(OH)3胶体 |
|
| 4. 选择题 | 详细信息 |
符合下图中阴影部分的物质是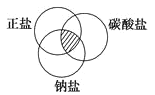 A.Na2CO3 B.NaHCO3 C.K2CO3 D.Na2SO4 |
|
| 5. 选择题 | 详细信息 |
|
A. C. |
|
| 6. 选择题 | 详细信息 |
|
化学上提出“有核模型”原子结构的科学家是 A.道尔顿 B.汤姆生 C.卢瑟福 D.波尔 |
|
| 7. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 最外层电子数大于4的一定是非金属元素 B. 元素周期表有18纵列,7横行,故有18个族,7个周期 C. 第ⅠA族就是碱金属 D. 某ⅡA族元素的原子序数为a,则和其同周期ⅢA的元素的原子序数可能为a+11 |
|
| 8. 选择题 | 详细信息 |
|
下列说法不符合第ⅦA族元素性质的是( ) A.从上到下元素的非金属性逐渐增强 B.易形成 C.从上到下最高价氧化物对应水化物的酸性逐渐减弱(F除外) D.从上到下单质的氧化性逐渐减弱 |
|
| 9. 选择题 | 详细信息 |
|
下列选项不能用来证明 A. C.酸性: |
|
| 10. 选择题 | 详细信息 |
|
Cl2用来消毒生活用水的原因是 A.Cl2能杀灭细菌 B.Cl2有毒 C.Cl2是氧化性很强的气体 D.Cl2与水反应生成HClO有强氧化性,可杀灭水中细菌 |
|
| 11. 选择题 | 详细信息 |
|
在未知液中加入 A. |
|
| 12. 选择题 | 详细信息 |
|
下列可用于检验实验室久置的FeSO4溶液是否含有Fe3+的试剂是 A. 石蕊试液 B. 酚酞试液 C. 新制氯水 D. KSCN溶液 |
|
| 13. 选择题 | 详细信息 |
|
每做一次焰色反应实验,都要用一种试剂洗净铂丝,这种试剂是( ) A.Na2CO3溶液 B.NaOH溶液 C.硫酸 D.盐酸 |
|
| 14. 选择题 | 详细信息 |
|
欲除去Na2CO3固体中的NaHCO3杂质,可采取的方法是 A.加水溶解后过滤 B.配成溶液后通入足量CO2气体 C.将固体加热 D.先加足量盐酸后过滤 |
|
| 15. 选择题 | 详细信息 |
|
下列有关试剂的保存方法不正确的是 A.少量的钠保存在煤油中 B.液氯贮存钢瓶中 C.氢氧化钠溶液长期保存在滴瓶中 D.新制的氯水保存在棕色玻璃试剂瓶中 |
|
| 16. 选择题 | 详细信息 |
|
下列关于化学键的叙述,正确的一项是 A.离子化合物中一定含有离子键 B.单质分子中均不存在化学键 C.含有极性键的分子一定是极性分子 D.含有共价键的化合物一定是共价化合物 |
|
| 17. 选择题 | 详细信息 |
|
设NA代表阿伏加德罗常数,下列说法正确的是( ) A.2.4g金属镁变成镁离子时失去的电子数目为0.1NA B.标准状况下,2.24L水中含有0.1NA个水分子 C.在25℃,压强为1.01×105Pa时,11.2L氮气所含的原子数目为NA D.标准状况下,1.12L氯气中含有0.1NA个氯原子 |
|
| 18. 选择题 | 详细信息 |
|
Cu2O是赤铜矿的主要成分,Cu2S是辉铜矿的主要成分。铜的冶炼过程通常发生反应:Cu2S+2Cu2O=6Cu+SO2↑,下列有关说法正确的是( ) A.该反应中有三种元素的化合价发生了变化 B.每生成0.1molCu,转移0.2mol电子 C.Cu2S在反应中既是氧化剂又是还原剂 D.Cu既是氧化产物又是还原产物 |
|
| 19. 选择题 | 详细信息 |
|
依据2Fe2++Cl2===2Fe3++2Cl-,HClO+H++Cl-===Cl2↑+H2O,2Fe3++Cu===2Fe2++Cu2+,Fe+Cu2+===Fe2++Cu,判断下列氧化剂的氧化性强弱顺序正确的是( ) A. Fe3+>HClO>Cl2>Fe2+>Cu2+ B. HClO>Cl2>Fe3+>Cu2+>Fe2+ C. Cl2>HClO>Fe3+>Cu2+>Fe2+ D. Fe3+>Cu2+>Cl2>HClO>Fe2+ |
|
| 20. 选择题 | 详细信息 |
|
下列离子方程式中,正确的是 A.将氧化镁与稀盐酸混合:MgO+2H+=Mg2++H2O B.AlCl3溶液中加入足量的氨水:Al3++4OH-=AlO C.将氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+ D.将铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
|
| 21. 选择题 | 详细信息 |
|
下列各组离子在溶液中能大量共存的是( ) A.Ag+、Cl-、SO C.Ca2+、HCO |
|
| 22. 选择题 | 详细信息 |
|
下列物质中,既能与强酸反应,又能与强碱反应的是 ①Na2CO3 ②Al ③Al2O3 ④NaHCO3 A.②③④ B.①②③ C.①③④ D.①②③④ |
|
| 23. 选择题 | 详细信息 |
|
下列实验操作中正确的是( ) A.用酒精萃取碘水中的碘 B.用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液完全蒸干 C.蒸馏操作时,应使温度计水银球插入液态混合物中 D.分液时,打开旋塞,使下层液体从下口流出,上层液体从上口倒出 |
|
| 24. 选择题 | 详细信息 |
|
下列各组中的两种物质作用,反应条件(温度或者反应物用量)改变,不会引起产物种类改变的是 A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.FeBr2和Cl2 |
|
| 25. 选择题 | 详细信息 |
某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的教材上的实验。实验操作:先给钠预热,当钠熔成圆球时,撤火、通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是( ) A.钠着火燃烧产生苍白色火焰 B.反应生成的大量白烟是氯化钠晶体 C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 D.管右端棉球外颜色变化可判断氯气是否被碱液完全吸收 |
|
| 26. 填空题 | 详细信息 |
|
根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题: (1)还原产物是______。还原剂与还原产物的物质的量之比为______。 (2)当有2 mol HNO3参加反应时,被氧化的物质质量为______g。 |
|
| 27. | 详细信息 |
|
已知A、B、C、D、E、F为短周期元素,A的原子最外层电子数与其周期数相同,A在E中燃烧,发出苍白色火焰,产物溶于水得到一种强酸,F和E的电子层数相同,FD2是形成酸雨的主要气体物质。B的最外层电子数是其所在周期数的2倍,B在D中充分燃烧能生成其最高价化合物BD2,C和D加热条件下可以生成淡黄色化合物W,C+与D2-具有相同的电子数。回答下列问题: (1)写出元素名称:A______,B______。 (2)F在元素周期表中的位置是______。 (3)E与F相比,原子半径E______F,非金属性E______F(填“>”或“<”)。 (4)写出BD2与W反应的化学方程式______; |
|
| 28. | 详细信息 |
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。 请根据以上信息回答下列问题: (1)写出下列物质的化学式:A______;H ______;乙______; (2)写出下列反应的离子方程式: 反应①______ 反应②______ |
|
| 29. 实验题 | 详细信息 |
|
某同学帮助水质检测站配制480 mL 0.5 mol/L NaOH溶液以备使用。 (1)该同学应选择______mL的容量瓶。 (2)其操作步骤如图所示,则图1中操作应在图中的_____(填选项字母)之间。   A.①与② B.②与③ C.③与④ D.④与⑤ (3)该同学应称取NaOH固体_______g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_______(填字母),并在图中选出能正确表示游码位置的选项_______(填字母)。 附表:砝码规格   (4)下列操作对所配溶液的浓度大小有何影响(填“偏大” “偏小”或“无影响”)。 ①定容时,俯视读数,浓度会_______; ②转移溶液过程中,少量液体溅出来,浓度会_______; ③定容摇匀后发现溶液凹面低于刻度线,浓度会_______。 |
|
| 30. 计算题 | 详细信息 |
|
将11.2g铁投入400 mL某浓度的盐酸中,铁和盐酸恰好完全反应。求: (1)11.2 g铁的物质的量_________; (2)所用盐酸中HCl中的物质的量浓度____________; (3)反应中生成的H2在标准状况下的体积_____________。 |
|
最近更新



