浙江高二化学2019年上半年开学考试试卷带解析及答案
| 1. 选择题 | 详细信息 |
|
下列属于酸性氧化物的是( ) A. |
|
| 2. 选择题 | 详细信息 |
|
下列属于电解质的是( ) A. 淀粉 B. 氨基乙酸 C. 盐酸 D. 蔗糖 |
|
| 3. 选择题 | 详细信息 |
|
下列物质的用途利用了其还原性的是( ) A. 用葡萄糖制镜子或保温瓶胆 B. 用硫粉覆盖洒落在桌上的Hg C. 用 D. 用 |
|
| 4. 选择题 | 详细信息 |
|
下列属于氧化还原反应但不属于四种基本反应类型的是( ) A. B. C. D. |
|
| 5. 选择题 | 详细信息 |
|
下列有关说法不正确的是( ) A. 人们最早先根据味道来获得朴素的酸、碱概念:一切有酸味的物质都是酸,一切有涩味的物质都是碱。 B. 波义耳基于指示剂变色来分辨酸碱:酸一定能使石蕊变红,碱一定能使石蕊变蓝。 C. 地球上最大规模的化学反应是植物的光合作用,人类利用氮肥的最有效的反应是合成氨反应。 D. 酸碱质子理论:凡是能给出 |
|
| 6. 选择题 | 详细信息 |
|
下列说法不正确的是( ) A. B. 氧化镁可用作耐高温材料 C. 硫酸铜可用于游泳池水的消毒 D. 二氧化硫可用于漂白纸浆 |
|
| 7. 选择题 | 详细信息 |
|
下列表示正确的是 A. 氯化镁的电子式: C. 乙炔分子的球棍模型:  |
|
| 8. 选择题 | 详细信息 |
|
下列说法不具有因果关系的是( ) A. 明矾溶于水后生成氢氧化铝胶体,因此具有净水能力 B. 纯碱水溶液呈碱性,因此可以去油污 C. 二氧化硅与氢氧化钠溶液反应生成硅酸钠,因此装氢氧化钠溶液的试剂瓶不能用玻璃塞 D. |
|
| 9. 选择题 | 详细信息 |
|
未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且可以再生。下列最有希望的新能源是( ) ①天然气 ②煤 ③石油 ④太阳能 ⑤氢能 ⑥酒精 A. ①③⑤ B. ②③④ C. ①④⑤ D. ④⑤⑥ |
|
| 10. 选择题 | 详细信息 |
|
下列说法不正确的是( ) A. 某试样焰色反应呈黄色,则试样中一定不含有 B. 鉴别 C. 容量瓶不能用作溶解物质的容器 D. 粗盐的提纯实验中,滤液在蒸发皿中加热蒸发结晶 |
|
| 11. 选择题 | 详细信息 | ||||||||||||||||||||
下列除去括号内的杂质选用的试剂及方法均正确的是( )
|
|||||||||||||||||||||
| 12. 选择题 | 详细信息 |
|
下列说法不正确的是( ) A. 石油分馏属于物理变化,煤的干馏属于化学变化 B. 煤气化生成的水煤气,再经过催化合成可得到液态烃 C. 足量乙烯通入溴的四氯化碳溶液中,溶液颜色由红棕色变成无色 D. 甲烷是一种高效的燃料,常温下性质稳定,即使高温也不会分解 |
|
| 13. 选择题 | 详细信息 | ||||||||||||
元素X、Y、Z和W在周期表中的位置如图所示,其中X、Y、Z均为短周期元素,且X、Y、W原子的最外层电子数之和为13。下列说法不正确的是( )
|
|||||||||||||
| 14. 选择题 | 详细信息 |
|
下列对于太阳能、生物质能和氢能的利用的说法不正确的是 ( ) A. 芒硝晶体(Na2SO4·10H2O)白天在阳光下曝晒后失水、溶解吸热,夜里重新结晶放热,实现了太阳能转化为化学能继而转化为热能 B. 将植物的秸秆、枝叶、杂草和人畜粪便加入沼气发酵池中,在富氧条件下,经过缓慢、复杂、充分的氧化反应最终生成沼气,从而有效利用生物质能 C. 生活、生产中大量应用氢能源,首先要解决由水制备氢气的能耗、氢气的储存和运输等问题 D. 垃圾焚烧处理厂把大量生活垃圾中的生物质能转化为热能、电能,减轻了垃圾给城市造成的压力,改善了城市的环境,增强了市民的环保意识 |
|
| 15. 选择题 | 详细信息 |
|
下列离子方程式能正确描述实验事实的是( ) A. 镁粉加到氯水中,氯水褪色: B. 双氧水和稀硫酸同时加到84消毒液中,产生大量气泡: C. D. 在 |
|
| 16. 选择题 | 详细信息 |
|
下列说法不正确的是( ) A. 干冰升华和液氯气化时,都只需克服分子间作用力 B. 硫酸氢钠晶体溶于水,需要克服离子键和共价键 C. D. 石墨转化为金刚石时,既有共价键的断裂,又有共价键的形成 |
|
| 17. 选择题 | 详细信息 |
|
下列说法正确的是 A. 石墨和C60互为同位素 B. CH3CH2OH和CH3OCH3互为同分异构体 C. l4CO2的摩尔质量为46 D. |
|
| 18. 选择题 | 详细信息 | ||||||||||||||||||||
将
|
|||||||||||||||||||||
| 19. 选择题 | 详细信息 |
|
设 A. 常温常压下, B. C. 标准状况下, D. 常温常压下 |
|
| 20. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 碳和氧气反应生成一氧化碳是吸热反应,是因为反应物的能量低于生成物的能量 B. 科学家从植物的光合作用得到启发,用二氧化碳与水来合成乙酸,反应原理为: C. D. 放热反应可能很难发生,吸热反应可能很容易反应 |
|
| 21. 选择题 | 详细信息 |
某热再生电池工作原理如下图所示。通入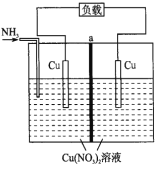 A. 此电池为二次电池 B. 放电时,左边电极发生氧化反应 C. a为阳离子交换膜 D. 放电时,转移 |
|
| 22. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. B. C. 葡萄糖溶液中加入新制 D. 纤维素的水解和油脂的皂化反应都是由高分子生成小分子的过程 |
|
| 23. 选择题 | 详细信息 |
|
体积固定的密闭容器中发生下列反应 A. 容器内压强不变 B. 容器内A、B、C、D、E五者共存 C. A、D的消耗速率相等 D. D、C的生成速率相等 |
|
| 24. 选择题 | 详细信息 |
工业制溴的大致流程如图: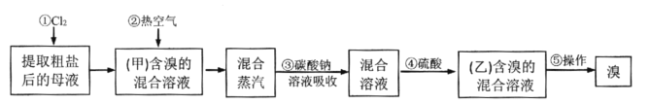 已知溴的沸点为58.7℃,常温下在水中的溶解度为3.58g;溴与碳酸钠溶液反应生成NaBr、NaBrO3、CO2等。则下列理解不正确的是( ) A. 步骤②通热空气是利用了溴的挥发性 B. 从混合液甲到混合液乙,目的是对溴进行富集 C. 步骤④加硫酸后发生氧化还原反应,其中氧化产物与还原产物的物质的量之比为1:1 D. 操作⑤可以采取萃取、分液、蒸馏 |
|
| 25. 选择题 | 详细信息 |
|
取某固体样品,进行如下实验: ①取a g样品,加足量水充分溶解,得澄清透明溶液,未产生浑浊; ②取20mL溶液,加入足量氯水,无气体产生,再加入CCl4后分层,下层为橙红色; ③将②中溶液分液后,在上层溶液加入足量 ④另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体; 该固体样品可能是( ) A. NH4Cl NaBr (NH4)2SO4 B. CuBr2 NaCl (NH4)2SO3 C. NaBr Na2CO3 (NH4)2SO4 D. NaCl NaBr (NH4)2SO3 |
|
| 26. 综合题 | 详细信息 |
乙炔是一种重要的化工原料,以乙炔为原料衍生出部分化工产品的反应如图(部分反应条件已略去):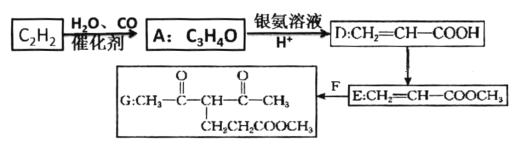 (1)A中官能团的名称为____,A→D的反应类型为:____。 (2)下列有关E的说法正确的是____(填字母序号)。 A.可发生氧化反应、取代反应 B.能与 C.易溶于水 D.是 (3)写出D→E反应的化学方程式:_____。 (4)已知E+F→G的反应中反应物的原子利用率为100%,写出F的结构简式____ |
|
| 27. 推断题 | 详细信息 |
有一种埋在地下的矿物X(仅含四种元素),挖出后在空气中容易发黄,现探究其组成和性质,设计完成如图实验: 请回答: (1)X的化学式____。 (2)X隔绝空气加热的化学反应方程式为:___。 (3)用化学方程式表示在空气中变黄的原因____。 (4)写出检验溶液A中存在的金属阳离子的实验方法:____。 |
|
| 28. 推断题 | 详细信息 |
|
元素A、B、D、E、F、G均为短周期主族元素,且原子序数依次增大,只有E为金属元素。已知A原子只有一个电子层;E、F的原子序数分别是B、D的2倍,其中D、F同主族,B、E不同主族。回答下列问题: (1)元素D在周期表中的位置____。 (2)F和G形成的化合物,分子中所有原子均为8电子稳定结构,该化合物的电子式为____。 (3)由上述元素组成的物质中,按下列要求写出化学方程式 ①两种弱酸反应生成两种强酸______; ②置换反应,且生成物在常温均为固态____。 (4)在D、F、G中选取2种元素组成具有漂白、杀菌作用的化合物___。 |
|
| 29. 计算题 | 详细信息 | ||||||||||||
在100mL碳酸钠与碳酸氢钠的混合溶液中,加入氢氧化钡溶液,生成的沉淀如表:
|
|||||||||||||
| 30. 综合题 | 详细信息 | ||||||||||
|
氮和氮的化合物在工农业生产、国防和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题: (1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂,可由Cl2和NO在通常条件下反应制得,反应方程式为 已知几种化学键的键能数据如表所示:
|
|||||||||||
| 31. | 详细信息 |
碘化钠在有机合成中用途广泛,工业制备碘化钠有多种方法,下图是制备碘化钠的两种方案。已知:3I2+6NaOH=5NaI+NaIO3+3H2O;N2H4·H2O的沸点118℃,100℃开始分解。 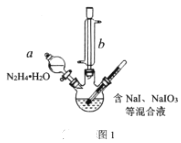  (1)方案一中加入N2H4·H2O后发生的离子反应为:2IO3-(aq)+3N2H4·H2O(l)=2I-(aq)+3N2(g)+7H2O(l) △H<0;部分装置如图1所示。 ①图1中仪器b的名称为___。若要使分液漏斗中的液体流入三颈烧瓶中,具体的操作是___。 ②实验过程中需控制反应温度70℃左右的原因是___。图1中加热的方式最好选用____。 (2)结合NaI溶解度曲线(如图2),流程图中方法②的具体操作为:加热蒸发、___、过滤、洗涤得到白色晶体。 (3)写出方案二中加入Fe屑后的离子方程式_____。 (4)方案二比方案一得到产品的产率略低,其原因是____。 |
|




