2018-2019年高二上册期末考试化学考试完整版(吉林省长春市第十一高中)
| 1. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列叙述正确的是 A. 15g甲基含有的电子数为10NA B. 1mol2,2,3-三甲基丁烷含有非极性共价键总数为23 NA C. 14g乙烯和环丙烷的混合物所含的原子总数为6NA D. 在常温常压下,11.2L CH3Cl的质量小于25.25g |
|
| 2. 选择题 | 详细信息 |
|
在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为目标产物,即原子利用率为100%.在下列反应中:①置换反应 ②化合反应 ③分解反应 ④取代反应⑤加成反应 ⑥消去反应 ⑦加聚反应 ⑧乙烯在Ag做催化剂被氧气氧化制环氧乙烷,能体现这一原子最经济原则的是 A. ①②⑤ B. ②⑤⑦⑧ C. 只有② D. 只有⑦ |
|
| 3. 选择题 | 详细信息 |
|
下列四个反应中有一个反应和其它三个反应原理不同,该反应是 A. MgCl2+H2O C. A1O2-+HCO3-+H2O=Al(OH)3↓+CO32- D. PCl5+4H2O=H3PO4+5HCl |
|
| 4. 选择题 | 详细信息 |
|
人类对某金属冶炼技术的掌握程度决定了其应用的广泛性。影响冶炼方法的主要因素是 A.金属的活动性大小 B.金属在地壳中的含量多少 C.金属的化合价高低 D.金属的导电性强弱 |
|
| 5. 选择题 | 详细信息 |
|
下列有关海水资源的综合利用不正确的是 A. 海水淡化的的方法有蒸馏法,电渗析法,离子交换法等 B. 用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁 C. 提取海带中的碘,首先将用刷子刷净并用酒精润湿的干海带在坩埚中灼烧 D. 提取海水中的溴,富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
|
| 6. 选择题 | 详细信息 |
|
有关煤的叙述中正确的是 A. 煤在空气中加强热可得焦炭,煤焦油,粗苯,粗氨水和焦炉气 B. 煤是由有机物和少量无机物组成的复杂的混合物,内含煤焦油等成分 C. 煤的气化主要反应是C(s)+H2O(g)=CO(g)+H2(g) D. 推广使用煤液化和气化技术,可减少二氧化碳等温室气体的排放 |
|
| 7. 选择题 | 详细信息 |
|
由A、B两种烃组成的混合物,当混合物总质量一定时,无论A、B以何种比例混合,完全燃烧消耗氧气的质量为一恒量。对A、B两种烃有下面几种说法:①互为同分异构体;②互为同系物;③具有相同的最简式;④两种烃中碳的质量分数相同。一定正确的结论是 A. ①②③④ B. ①③④ C. ②③④ D. ③④ |
|
| 8. 选择题 | 详细信息 |
|
能一次区分CH3COOH、C2H5OH、 A. 溴水 B. Na2CO3稀溶液 C. pH试纸 D. 蓝色石蕊试纸 |
|
| 9. 选择题 | 详细信息 |
|
下列关于石油及石油炼制的叙述中,错误的是 A. 通过石油的催化裂化和裂解可以得到较多的轻质油和气态稀烃 B. 含C20以上烷烃的重油经减压分馏可以得到煤油和柴油 C. 裂化汽油不能用于萃取溴水,催化重整可得芳香烃 D. 石油分馏是物理变化,分馏得到的各馏分仍是多种烃的混合物 |
|
| 10. 选择题 | 详细信息 |
|
10L含有丙烯,丁炔和甲烷的混合物与足量O2混合点燃后,恢复到原来状态(常温、常压),气体体积共缩小21L ,则甲烷的体积分数为 A. 20% B. 30% C. 80% D. 无法确定 |
|
| 11. 选择题 | 详细信息 |
|
某有机物的结构简式为: CH3─ 它可能有下列性质①能被酸性高锰酸钾氧化②1mol该物质最多能和含溴4mol的溴水发生加成反应③分子式为:C11H14O④能发生水解反应⑤能和钠反应⑥1mol该物质最多能和4mol的氢气发生加成反应⑦能在铜做催化剂的条件下被氧气氧化⑧能发生加聚反应⑨能在光照的条件下和氯气发生取代反应.下列组合正确的是( ) A. ①②③⑤⑥⑦⑧⑨ B.①③⑤⑥⑦⑧⑨ C. ①②③④⑤⑥⑦⑧ D.①②③④⑤⑦⑧⑨ |
|
| 12. 选择题 | 详细信息 |
|
某烃的结构简式CH3CH2CH=C(C2H5)C≡CH,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数最多为b、一定在同一平面内的碳原子数为c,则a、b、c分别为 A. 4、3、5 B. 4、3、6 C. 2、5、4 D. 4、6、4 |
|
| 13. 选择题 | 详细信息 |
|
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( ) A. 水的电离程度始终增大 B. c(NH4+)/c(NH3·H2O)先增大再减小 C. c(CH3COOH)与c(CH3COO-)之和始终保持不变 D. 当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-) |
|
| 14. 选择题 | 详细信息 |
|
1500C、1.0×105Pa时,aL乙炔,aL甲烷和aL丙烯的混合气体与过量的bLO2混合,点燃使这两种烃充分燃烧后,再恢复到原状况,此时混合气体的体积为 A. 10aL B. (3a+b)L C. (b-a)L D. 无法计算 |
|
| 15. 选择题 | 详细信息 |
|
某混合气体由两种气态烃组成,取4.48L该混合气体完全燃烧后得到26.4g二氧化碳(气体已折算为标准状况)和10.8g水,则这两种气体可能是 A. CH4和C4H8 B. C2H4和C4H8 C. C2H4和C3H8 D. C2H2和C4H6 |
|
| 16. 选择题 | 详细信息 |
|
蒽的结构如图所示 A. 13种 B. 14种 C. 15种 D. 16种 |
|
| 17. 选择题 | 详细信息 |
|
无论以何种比例混合的10mL混和气,在50mL的氧气中燃烧生成CO2和液态的H2O,燃烧后所得气体的体积为35mL,则该混合物可能为 A. C3H6 C4H6 B. C2H6 C3H6 C. C2H4 C3H8 D. C2H2 C2H6 |
|
| 18. 选择题 | 详细信息 |
|
已知常温下,Ksp(AgCl)=1×10-10,Ksp(AgI)=1×10-18。下列叙述中正确的是( ) A. 常温下,AgCl在NaCl溶液中的Ksp比在纯水中的Ksp小 B. 常温下,AgI若要在NaCl溶液中开始转化为AgCl,则NaCl的浓度必须大于0.1mol·L C. 将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先析出AgI沉淀 D. 向AgCl饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) |
|
| 19. 选择题 | 详细信息 |
|
现有常温下的四种溶液:①0.1 mol·L-1 NH4Cl溶液 ②0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O的混合溶液(显碱性)③0.1 mol·L-1 NH3·H2O ④0.1 mol·L-1 NH4Cl和0.1 mol·L-1 HCl的混合溶液下列说法不正确的是( ) A. NH4+离子浓度由大到小的顺序为②>④>①>③ B. NH3·H2O分子浓度由大到小的顺序为②>③>①>④ C. 溶液的pH由大到小的顺序为③>②>①>④ D. 溶液中的离子总浓度由大到小的顺序为④>①>②>③ |
|
| 20. 填空题 | 详细信息 |
|
按要求填空 (1)羟基的电子式________________; (2)电石气的分子式___________; (3)顺式-2-丁烯的结构简式__________________; (4) (5)写出由甲苯制TNT的方程式_________________________________________ (6)2﹣甲基﹣1、3﹣丁二烯与等物质的量的Br2发生加成反应,产物可能有________种 (7)某苯的同系物的相对分子质量是92,在光照下,Cl2可以和其发生取代反应,取代产物的相对分子质量是126.5。写出该反应方程式_________________________________ (8)检验己烯中是否混有甲苯的试剂是________________________________________ |
|
| 21. 填空题 | 详细信息 |
|
相对分子质量为84的烃,能使溴水褪色 (1)如该烃分子中所有的碳原子都在同一个平面内,则该烃的结构简式为:______________该烃和1,3-丁二烯发生加聚反应的产物的结构简式__________________________ (2)如该烃和溴化氢加成只能生成一种产物,则满足该要求的该烃有_____________种; (3)如该烃分子组成含有两个甲基,则满足该要求的该烃有_____________种。 |
|
| 22. 填空题 | 详细信息 |
|
已知常温下某二元弱酸(H2R)电离常数为Ka1=5×10-7,Ka2=5.6×10-11,HClO的Ka=3.0×10-8,回答下列问题: (1)常温下向NaClO溶液加入少量的H2R溶液发生反应的离子方程式为___________________ (2)常温下pH=3的HClO溶液浓度为C1,pH=4的HClO溶液浓度为C2,则C1____10C2(填“>”、“<”或“=”) (3)常温下2mol/L的H2R溶液的pH约为_______________ (4)常温下0.1mol/L的NaHR溶液pH__________7(填“>”、“<”或“=”),溶液中的阴阳离子的浓度由大到小的顺序为___________________________________________ (5)常温下,向10 mL 0.1 mol/LH2R溶液中滴加0.1 mol·L-1的KOH溶液V mL ①若混合后的溶液中离子浓度有如下关系:c(K+)=2c(R2-)+c(HR-),V______10(填“>”、“<”或“=”)。 ②当混合后的溶液中离子浓度有如下关系:c(K+) = c(R2-)+c(HR-)+c(H2R),则溶液中溶质为_____________,V______10(填“>”、“<”或“=”)。 ③当V=30时,混合后的溶液中c(OH-)-c(H+)-c(HR-)-2c(H2R)=________mol/L。 |
|
| 23. 实验题 | 详细信息 |
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用如图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液。试管d中装有浓溴水(表面覆盖少量水)。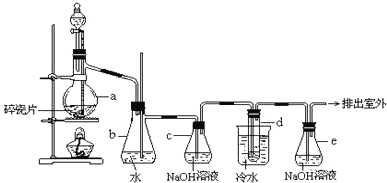 请填写下列空白: (1)烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速升高到170℃,否则容易发生副反应。请写出乙醇发生消去反应的方程式 ____________。 (2)写出制备1,2-二溴乙烷的化学方程式:____________。 (3)安全瓶b可以防止倒吸,并可以检査实验进行时试管d是否发生堵塞,请回答发生堵塞时瓶b中的现象:___________________。 (4)容器c中NaOH溶液的作用是:_________________。 (5)若产物中有少量副产物乙醚,可用_______________________的方法除去; (6)反应过程中应用冷水冷却装置d,其主要目的是_______________。 |
|
最近更新



