2019-2020年高一上半年期中考试化学试卷(云南大学附中星耀校区)
| 1. 选择题 | 详细信息 |
【改编题】对于易燃、易爆、有毒的化学物质,往往会在其包装上贴上危险警告标签。下面所列物质,贴错了包装标签的是( ) 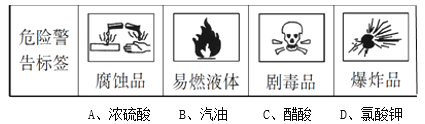 |
|
| 2. 选择题 | 详细信息 |
|
我国明代《本草纲目》中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( ) A.萃取 B.洗气 C.蒸馏 D.干馏 |
|
| 3. 选择题 | 详细信息 |
|
在日常生活中会接触到许多物质。下列物质中属于碱性氧化物的是( ) A.七氧化二锰 B.生石灰 C.二氧化碳 D.乙醇 |
|
| 4. 选择题 | 详细信息 |
|
下雪时,常用融雪剂清理路面,醋酸钾(CH3COOK)是效果较好的融雪剂。下列关于1mol CH3COOK的叙述正确的是( ) A.1 mol CH3COOK含有1mol钾元素 B.CH3COOK的摩尔质量为98g C.1mol CH3COOK含有2mol氧 D.1mol CH3COOK含有3×6.02×1023个H |
|
| 5. 选择题 | 详细信息 |
|
将下列各组物质按单质、酸、碱、盐分类顺序排列,其中正确的是( ) A.水银、硫酸、烧碱、硫酸氢钠 B.氯水、盐酸、火碱、硫酸钡 C.臭氧、硝酸、纯碱、胆矾 D.铜、醋酸、石灰石、氯化铜 |
|
| 6. 选择题 | 详细信息 |
|
下列仪器能直接用酒精灯加热的是( ) ①量简 ②表面皿 ③烧杯 ④试管 ⑤容量瓶 ⑥蒸发皿 ⑦坩埚 ⑧烧瓶 A.②③④⑤⑥⑦⑧ B.③⑥⑦ C.④⑥⑦ D.④⑦⑧ |
|
| 7. 选择题 | 详细信息 |
|
下列操作过程中一定有氧化还原反应发生的是( ) A. 蒸发氯化钠溶液  B. 将盐酸滴入碳酸钠溶液中 B. 将盐酸滴入碳酸钠溶液中 C. 蔗糖溶解 C. 蔗糖溶解 D. 磷在氧气中燃烧 D. 磷在氧气中燃烧 |
|
| 8. 选择题 | 详细信息 |
实验室常用氢氧化钠溶液吸收氯化氢尾气,以防止环境污染。下列既能吸收尾气,又能防止溶液倒吸的装置是( )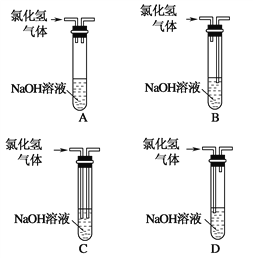 |
|
| 9. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列叙述正确的是( ) A.标准状况下,22.4L H2O含有分子数为NA B.分子总数为NA的N2、CO混合气体体积约为22.4L,质量为28g C.常温常压下,1.6g CH4含原子数为0.5NA D.0.2mol/L K2SO4溶液中有0.4NA个K+ |
|
| 10. 选择题 | 详细信息 |
|
将某溶液逐滴加入Fe(OH)3溶胶内,开始时不产生沉淀,滴入一定量后有沉淀产生,继续滴加时沉淀又溶解,该溶液是( ) A.2 mol·L-1 H2SO4溶液 B.2 mol·L-1 NaOH溶液 C.2 mol·L-1 MgSO4溶液 D.硅酸溶胶 |
|
| 11. 选择题 | 详细信息 |
|
下列离子方程 式书写正确的是( ) A.铜片插入硝酸银溶液中 :Cu+Ag+=Cu2++Ag B.醋酸溶解鸡蛋壳:2H++CaCO3=Ca2++CO2↑+H2O C.在NaHSO4溶液中滴入Ba(OH )2溶液至溶液呈中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O D.在 NaHCO3 溶液中滴入少量澄清石灰水 :2HCO3- +Ca2++2OH-=CaCO3↓+2H2O+HCO3- |
|
| 12. 选择题 | 详细信息 |
化学概念在逻辑上存在如下关系: 对以上概念的说法正确的是( ) A.化合物与纯净物属于重叠关系 B.化合物与碱性氧化物属于交叉关系 C.分解反应与复分解反应属于交叉关系 D.置换反应与氧化还原反应属于包含关系 |
|
| 13. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A.凡是盐在离子方程式中都要以离子形式表示 B.离子反应总是向着溶液中反应物某种离子浓度减小的方向进行 C.能发生丁达尔效应是胶体与其他分散系的本质区别 D.溶液呈电中性,胶体带有电荷 |
|
| 14. 选择题 | 详细信息 |
|
题目下列各组微粒中,在化学反应中常做氧化剂的是( ) A.Fe3+、MnO4-、NO3- B.F-、Br- 、S2- C.Cl-、HClO、ClO- D.ClO-、CO、Ag+ |
|
| 15. 选择题 | 详细信息 |
|
把0.05mol NaOH固体分别加入到100mL下列液体中,溶液导电能力变化最小的是( ) A.自来水 B.0.5mol/L盐酸 C.0.5mol/L HAc溶液 D.0.5mol/L KCl溶液 |
|
| 16. 选择题 | 详细信息 |
|
用10mL 0.1mol/L的BaCl2溶液恰好可使相同体积的硫酸铝、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液中的金属阳离子物质的量浓度之比是( ) A.2 : 3 : 6 B.1 : 2 : 3 C.1 : 3 : 3 D.3 : 1 : 1 |
|
| 17. 选择题 | 详细信息 |
|
在同温同压下,用等质量的H2、CH4、CO2、HCl四种气体分别吹起四个气球,其中是由CO2吹起的是 A.  B. B.  C. C.  D. D.  |
|
| 18. 选择题 | 详细信息 |
|
能在无色溶液中大量共存的一组离子是( ) A.NH4+、SO42-、OH-、K+ B.Fe3+、NO3-、Cl-、H+ C.K+、HCO3-、Cl-、H+ D.H+、Na+、Cl-、SO42- |
|
| 19. 选择题 | 详细信息 |
|
下列实验操作中不正确的是( ) A.配制一定物质的量浓度的溶液时,容量瓶用蒸馏水洗涤后未蒸干就进行实验不会影响实验结果 B.蒸馏操作时,温度计水银球部分置于蒸馏烧瓶的支管口附近 C.分液操作时,分液漏斗中下层液体从下口放出,上层液体要从上口放出 D.在加入稀硝酸后的溶液中,滴加BaCl2溶液,有白色沉淀生成,证明原溶液中一定有SO42- |
|
| 20. 选择题 | 详细信息 |
|
已知还原性Cl- < Fe2+ < H2O2 < I- < SO2判断下列反应不能发生的是( ) A.2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ B.I2+SO2 +2H2O=H2SO4+2HI C.H2O2 +2H+ +SO42-=SO2 +O2+2H2O D.2 Fe3++2I-=2 Fe2+ +I2 |
|
| 21. 选择题 | 详细信息 |
|
最近在全国各地发现某知名护肤品中铬和钕等重金属含量超标,专家建议停用该产品,下面有关铬和钕的描述中,正确的是( ) A.钕是一种电解质 B.K2Cr2O7中Cr价态较低,经常在反应中做为还原剂 C.酒精测定仪中发生的化学反应如下:3CH3CH2OH+2K2Cr2O7+8H2SO4=3CH3COOH+Cr2(SO4)3+ K2SO4+11H2O,1mol K2Cr2O7反应转移的电子数目为3NA D.CrO42-和 Cr2O72- 了中 Cr元素的化合价相同 |
|
| 22. 选择题 | 详细信息 |
|
在体积为V L的密闭容器中通入a mol CO和b mol O2,点燃充分反应后容器内碳原子数和氧原子数之比为( ) A. a:b B. a:2b C. a:(a+2b) D. a:2(a+b) |
|
| 23. 选择题 | 详细信息 |
|
在实验室中常用KMnO4代替MnO2与浓盐酸反应制取氯气其反应的化学方程式为2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O下列叙述中正确的是( ) A.浓盐酸在此反应中体现出来氧化性和酸性 B.氧化产物与还原产物的物质的量之比为5:2 C.MnCl2和KCl是还原产物,且成比例生成 D.氧化剂和边原剂的比是1: 8 |
|
| 24. 综合题 | 详细信息 |
|
以下12种物质为中学化学常见的物质。 ①水银 ②NaCl ③NaHCO3 ④干冰 ⑤H2SO4 ⑥C2H5OH ⑦熔融的CaCO3 ⑧大理石⑨Cu(OH)2 ⑩Fe(OH)3胶体 ⑪ S ⑫氨水请按下列分类标准回答问题: (1)属于非电解质的是________________:(填序号,下同)能导电的是_____________。 (2)制备Fe(OH)3胶体的化学方程式为______________,当看到溶液呈________色时,则代表胶体已经制备完成。Fe(OH)3胶体中常混有FeCl3和HCl,将其装入半透膜袋,浸入蒸馏水中进行分离,该分离方法称为________;面粉厂静电除尘利用的原理是胶体的_____________。 (3)写出③NaHCO3在水溶液中的电离方程式_____________;将干冰升华过后的少量气体通入NaOH溶液中,试写出反应的离子方程式_________。 |
|
| 25. 推断题 | 详细信息 |
|
有一瓶溶液只含Cl- 、CO32-、SO42-、Na+、M g 2+、Cu2+六种离子中的某几种。通过实验 : ①原溶液加入足量NaOH溶液产生白色沉淀; ②原溶液中加BaCl2溶液不产生沉淀; ③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解; 回答下列问题: (1)试分析原溶液中一定含有的离子是_________,一定不含有的离子是_________,可能含有的离子_________(以上三空均填离子符号); (2)有的同学认为实验③可以省略,你认为否正确______(填是或否),理由是___________________。 |
|
| 26. 计算题 | 详细信息 |
|
(1)3.01×1023个NH4+含有质子的物质的量是______mol,含有电子的物质的量是______mol。 (2)200mL 2mol/L的Al2(SO4)3 溶液中SO42-的物质的量浓度为_________。 (3)标准状况下36g H2和O2组成的混合气体的体积是67.2L 。求这种混合气体中H2和O2的体积比为____________。 (4)同温同压下,质量比为17:48的NH3和CH4两种气体,密度之比为_________。 (5)已知1.505×1023个A气体分子质量为31g ,则A气体的摩尔质量是_________。 |
|
| 27. 实验题 | 详细信息 |
人体血液里 Ca2+的浓度一般采用mg/cm3 来表示。抽取一定体积的血样加适量的草酸钱[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液与之反应即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度: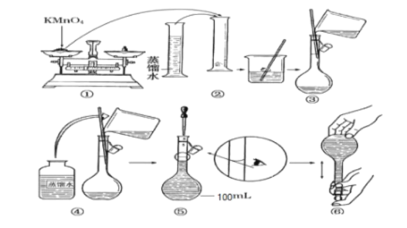 (实验探究一 : 配制酸性KMnO4标准溶液)如图是配制l00mL酸性KMnO4标准溶液的过程示意图 : (1)请你观察图示判断其中不正确的操作有________________(填序号)。 (2)配置上述溶液,需要使用的玻璃仪器是量筒、烧杯、玻璃棒、_______________(填名称)。 (3)按照图示的操作配制溶液,所得KMnO4标准溶液的浓度将________________(填 偏大 或 偏小 或者 无影响,下同)。如未冷却至室温就进行液体转移,则其所配的氯化钾溶液的浓度_____;若用托盘天平时错把砝码放在左边,把药品放在右边称量,则其所配氯化钾溶液的浓度_______。 (实验探究二:测定血液样品中Ca2+的浓度)抽取血样20.00mL经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液与之反应,使草酸转化成CO2 逸出,这时共消耗12.00mL酸性KMnO4溶液 。 (4)已知草酸跟酸性KMnO4溶液反应的离子方程式为 :2MnO4-+5H2C2O4+6 H+ =2Mnx++l0CO2↑+8H2O 则式中的x=_______。 (5)经过计算,血液样品中Ca2+的浓度为____mg/mL。 |
|
| 28. 推断题 | 详细信息 |
某废液中含有 大量 的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴,(Br2常温下是深红棕色液体),设计了如下的流程图: 可供选择的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2 溶液(H+)、KMnO4溶液(H+)、盐酸。请根据流程图回答相关问题 : (1)若试剂a为H2O2溶液(H+),已知H2O2+2KBr+2HCl=Br2+2H2O+2KCl, ①发生反应的离子方程式为:___________。 ②每消耗0.2mol H2O2,反应转移的电子数为_______mol。 ③还原剂和还原产物的物质的量之比是_____________。 (2)操作①②③④⑤对应的名称分别是:萃取、_________、蒸馏、过滤、__________。蒸馏过程用到下图装置的名称是A____________ B____________。  (3)为了除去无色液体中的Ca2+、Mg2+、SO42-,从可供选则试剂中选择试剂b所代表的物质,按照滴加的顺序依次是_______、_________、_________(填化学式)。 (4)调节pH=7是为了除去杂质离子_______和________,以提高氯化钾晶体的纯度。 |
|
| 29. 计算题 | 详细信息 |
|
高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,实验室制取高铁酸钠的化学方程式如下 : (1)请用双线桥法表达出此反应的电子转移情况:__________ 2Fe( NO3 )3+16NaOH+3Cl2=2Na2FeO4+6NaNO3 +6NaCl+8H2O (2)若要制取8.3g高铁酸钠需要标准下Cl2的体积为多少?______若所用氢氧化钠溶液体积为200mL,则氢氧化钠溶液的物质的量浓度是多少?(写出计算过程)_______ |
|
最近更新



