江西省鹰潭市贵溪市实验中学2020--2021年高二上半年第二次月考化学题免费试卷
| 1. 选择题 | 详细信息 |
|
下列变化过程,属于放热反应的是( ) ①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体NaOH溶于水 ⑤H2在Cl2中燃烧. A.②③④⑤ B.②③④ C.②⑤ D.①③⑤ |
|
| 2. 选择题 | 详细信息 |
|
下列说法或表示方法中正确的是( ) A.HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=-2×57.3kJ·mol-1 B.相同条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 C.由C(金刚石)=C(石墨)ΔH=-1.9kJ·mol-1可知,金刚石比石墨稳定 D.若CO(g)的燃烧热ΔH=-283.0kJ·mol-1,则反应2CO2(g)=2CO(g)+O2(g)的ΔH=+2×283.0kJ·mol-1 |
|
| 3. 选择题 | 详细信息 |
|
化学反应4A(s)+3B(g) A.用A表示的反应速率是0.4 mol·L-1·min-1 B.前2 min,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的 C.2 min末的反应速率用B表示是0.3 mol·L-1·min-1 D.用C表示的反应速率是0.2 mol·L-1·min-1 |
|
| 4. 选择题 | 详细信息 |
|
已知反应2CO(g)+4H2(g) A.v(H2O)=0.1mol·L-1·s-1 B.v(H2)=4.5mol·L-1·s-1 C.v(CH2=CH2)=0.03mol·L-1·s-1 D.v(CO)=1.5mol·L-1·s-1 |
|
| 5. 选择题 | 详细信息 |
把lmol CO2 和3mol H2通入1L的密闭容器中,在某温度下发生反应:CO2 (g)+3H2 (g) A.3min时,v正=v逆 B.0-10mim 内,用H2表示的反应速率为2.25 mol·L·min-1 C.该温度下,反应达到平衡时,H2的转化率为75% D.若升高温度,则CO2的转化率增大 |
|
| 6. 选择题 | 详细信息 |
|
对可逆反应2A(s)+3B(g) ①增加A的量,平衡向正反应方向移动;②升高温度,平衡向逆反应方向移动,v(逆)增大,v(正)减小;③压强增大一倍,平衡不移动,v(正)、v(逆)不变;④增大B的浓度,v(正)>v(逆);⑤加入催化剂,B的转化率提高 A.①② B.④ C.③④ D.④⑤ |
|
| 7. 选择题 | 详细信息 | ||||||||||||
下列实验方案,不能达到相应实验目的的是( )
|
|||||||||||||
| 8. 选择题 | 详细信息 |
已知:NO2(g)+CO(g) A.△H=-234kJ•mol-1 B.该反应的逆反应的活化能为368kJ•mol-1 C.加入高效催化剂,E1、E2均减小 D.其他条不变,缩小容器体积,活化分子百分数增大 |
|
| 9. 选择题 | 详细信息 |
|
在一个绝热恒容的密闭容器中发生可逆反应:mA(g)+nB(g) A.体系的压强不再改变 B.混合气体的密度不再改变 C.v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q D.体系的温度不再变化 |
|
| 10. 选择题 | 详细信息 |
|
25℃时,水的电离达到平衡H2O A.将水加热,Kw增大,pH不变 B.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 C.向水中加入少量固体NaHSO4,c(H+)增大,Kw不变 D.该温度下的0.01mol/L稀盐酸溶液中,由水电离的c(H+)=1×10-2mol/L |
|
| 11. 选择题 | 详细信息 |
|
25 ℃时,某溶液中水电离出的c(H+)=10-5mol·L-1,则该溶液可能是下列情况中的( ) A.该溶液可能是酸溶液 B.该溶液可能是碱溶液 C.该溶液中c(OH-)可能是10-5mol·L-1 D.该溶液与pH=9的氢氧化钠等体积混合,混合后溶液肯定呈中性 |
|
| 12. 选择题 | 详细信息 |
关于下列各实验或装置的叙述中,不正确的是( )  A.①可用于测溶液pH B.②是用酸性KMnO4溶液滴定Na2SO3溶液 C.③是滴定操作时手的操作 D.④中滴入一滴NaOH标准液使溶液由无色变为红色,即达到滴定终点 |
|
| 13. 选择题 | 详细信息 |
|
下列说法正确的是 A.pH=1的醋酸加水稀释到原体积的100倍,稀释后pH=3 B.室温下pH=3的醋酸溶液和pH=11的Ba(OH)2溶液等体积混合后溶液呈酸性 C.把pH试纸直接插入待测溶液中,测其pH D.某温度下,水的离子积常数为1×10-12,该温度下pH=7的溶液呈中性 |
|
| 14. 选择题 | 详细信息 |
|
醋酸溶液中存在电离平衡 CH3COOH A.升高温度,平衡正向移动,醋酸的电离常数 Ka 值增大 B.0.10 mol·L-1 的 CH3 COOH 溶液中加水稀释,溶液中 c(H+)减小 C.CH3COOH 溶液中加少量的 CH3COONa 固体,平衡逆向移动 D.25℃时,欲使醋酸的电离常数 Ka 和电离程度都减小,可加入少量冰醋酸 |
|
| 15. 选择题 | 详细信息 |
|
常温下,下列各溶液中微粒的物质的量浓度关系正确的是 A.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c( B.将pH=6的H2SO4稀释1000倍后,c(H+)=2c( C.浓度分别为0.1 mol·L-1和0.01 mol·L-1的CH3COOH溶液中:c(CH3COO-)前者是后者的10倍 D.NaA溶液的pH=8,c(Na+)-c(A-)=9.9×10-7 mol·L-1 |
|
| 16. 选择题 | 详细信息 | |||||||||||||||
现有室温下四种溶液,有关叙述不正确的是
|
||||||||||||||||
| 17. 填空题 | 详细信息 |
2016年9月我国成功利用大功率运载火箭发射“天宫二号”空间实验室。火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),如图是一定量肼完全燃烧生成氮气和1 mol气态水过程中的能量变化图。 (1)该反应反应物的总能量______生成物的总能量,属于_______(填“吸热”或“放热”)反应。 (2)写出该火箭推进器中相关反应的热化学方程式:___________。 (3)若该火箭推进器中有36g H2O生成,则转移的电子数为___________mol。 |
|
| 18. 填空题 | 详细信息 |
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C的变化如图所示。 (1)写出反应的化学方程式______。 (2)0~4min时,A的平均反应速率为______。 (3)已知:K(300℃)>K(350℃),该反应是______(填“吸热”或“放热”)反应。 (4)T℃时,反应的平衡常数为______(保留到小数点后2位)。 (5)到达平衡时B的转化率为______。 (6)如图是上述反应平衡混合气中C的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是______(填“温度”或“压强”)。判断L1_____L2(填“>”或“<”),理由是_____。 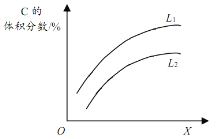 |
|
| 19. 填空题 | 详细信息 |
|
水体中的含氮化合物是引起富营养化的主要污染物,分析监测水体中的硝酸(盐)和亚硝酸(盐)含量,控制水体中的含氮污染物,对水资源的循环利用意义重大。 (1)亚硝酸(HNO2)是一种弱酸,其电离方程式为___________,其电离平衡常数的表达式为___________。 (2)水体中亚硝酸的含量可以利用KI溶液进行分析测定。该测定反应中,含氮的生成物可以是NO、N2O、NH2OH、NH3等。 ①NH2OH中,氮元素的化合价为___________。 ②某水样中含有亚硝酸盐,加入少量稀硫酸酸化后,用KI溶液测定,且选用淀粉溶液作指示剂,反应中含N的生成物为NO,反应的离子方程式为___________,其中氧化产物为___________(写化学式)。 ③取20mL含NaNO2的水样,酸化后用0.001mol/L的KI标准溶液滴定(反应中含N的生成物为NO),滴定前和滴定后的滴定管内液面高度如图所示,由此可知水样中NaNO2的浓度为___________mg/L。  |
|
| 20. 填空题 | 详细信息 |
|
弱酸的电离平衡常数与对应酸根的水解平衡常数存在某种定量关系。 (1)NO2可用氨水吸收生成NH4NO3。25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是___(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将___(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为___mol·L-1(NH3·H2O的电离平衡常数取Kb=2×10-5)。 (2)已知常温下CN-的水解常数Kh=1.61×10-5。 ①含等物质的量浓度HCN与NaCN的混合溶液显___(填“酸”“碱”或“中”)性,c(CN-)___(填“>”“<”或“=”)c(HCN)。溶液中各离子浓度由大到小的顺序为___。 ②常温下,若将cmol·L-1的盐酸与0.62mol·L-1的KCN等体积混合后恰好得到中性溶液,则c=___(小数点后保留4位数字)。 |
|
最近更新







