盈江县一中2019年高二化学上半年开学考试在线做题
| 1. 选择题 | 详细信息 |
|
下列反应中属于氧化还原反应的离子方程式的是 A.CaCO3+2H+=Ca2++CO2↑+H2O B.2Fe2++Cl2=2Fe3++2Cl C.HCO3+H+=CO2+H2O D.Na2O+H2O=2Na++2OH |
|
| 2. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 煤的干馏就是加热除去煤中的水分,得到干燥的炭 B. 煤中含有甲苯、二甲苯等,可通过干馏得到 C. 以煤为主要原料,可以合成甲醇 D. 煤干馏得到的焦炉气不能与溴水反应而使溴水褪色 |
|
| 3. 选择题 | 详细信息 |
|
A. C. |
|
| 4. 选择题 | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列说法正确的是( ) A. 标准状况下,22.4 L氢气中含有2NA个中子 B. 0.1NA个氯化氢分子占有体积为2.24 L C. 2克金属钙变成钙离子时失去的电子数为0.1NA D. 50 mL 0.1 mol·L-1H2SO4溶液中含有H+数为0.005NA |
|
| 5. 选择题 | 详细信息 |
|
关于地壳中含量占第一位和第二位的元素之间形成的化合物,有关其说法正确的是 A. 化学性质不活泼 B. 可溶于水且显酸性 C. 熔沸点较低,物理性质与CO2相似 D. 是酸性氧化物,不溶于任何酸 |
|
| 6. 选择题 | 详细信息 |
|
实现Al3++3AlO2-+6H2O===4Al(OH)3↓,正确的做法是( ) A. 向偏铝酸钠溶液中不断滴入盐酸溶液 B. 向烧碱溶液中不断滴入铝盐溶液 C. 偏铝酸钠溶液中通入过量的二氧化碳 D. 向铝盐溶液中不断滴入烧碱溶液 |
|
| 7. 选择题 | 详细信息 |
|
下列说法不正确的是( ) A. 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 B. 煤可与水蒸气反应制成水煤气,水煤气的主要成分为一氧化碳和氢气 C. 汽油、煤油、柴油和植物油都是碳氢化合物 D. 以石油、煤和天然气为原料,可生产塑料、合成橡胶和合成纤维 |
|
| 8. 选择题 | 详细信息 |
|
浓盐酸与次氯酸钙能发生反应Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质是( ) ①CO2 ②HCl ③H2O(g) ④O2 A. ①②③ B. ②③④ C. ②③ D. ①④ |
|
| 9. 选择题 | 详细信息 |
|
下列属于铵盐的共同性质的是( ) A. 都是晶体,都易溶于水 B. 铵盐受热均可分解生成NH3 C. 铵盐都能与碱反应,不能与酸反应 D. 所有铵盐中,氮元素化合价都是-3价 |
|
| 10. 选择题 | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列说法正确的是: A.在1 L 0.1 mol/L的碳酸钠溶液中,氧原子总数为0.3 NA B.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为1NA C.常温常压下,32 g O2—中所含电子的数目为20NA D.标准状况下,11.2 L苯中含有分子的数目为0.5 NA |
|
| 11. 选择题 | 详细信息 |
|
学生将一小块金属钾投入滴有酚酞的水中,这种操作能证明下述四点性质中的( ) ①钾比水轻;②钾的熔点较低;③钾与水反应时要放出热量;④钾与水反应后溶液显碱性 A. 仅①④ B. 仅④ C. 除②外 D. 全部 |
|
| 12. 选择题 | 详细信息 |
|
SO2能使浸过溴水的滤纸褪色,这说明了( ) A. SO2具有漂白性 B. 溴具有氧化性 C. SO2具有氧化性 D. 溴具有挥发性 |
|
| 13. 选择题 | 详细信息 |
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是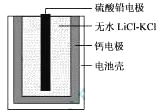 A. 正极反应式:Ca + 2Cl--2e- = CaCl2 B. 放电过程中,Li+向负极移动 C. 没转移0.1mol电子,理论上生成20.7 g Pb D. 常温时,在正负极间接上电流表或检流计,指针不偏转 |
|
| 14. 选择题 | 详细信息 |
|
当溶液被水稀释时,如温度不变,则下列诸量保持不变的是( ) A. 溶液质量 B. 溶剂质量 C. 溶质溶解度 D. 溶液的溶质质量分数 |
|
| 15. 选择题 | 详细信息 |
|
海水提碘时,不小心将碘与食盐混合,欲将二者分离开,最好的方法是( ) A. 溶解、过滤 B. 溶解、过滤、蒸发 C. 溶解、加硝酸银溶液、过滤 D. 加热使碘升华 |
|
| 16. 选择题 | 详细信息 |
|
过滤和蒸发结晶实验中,都可能用到的仪器是( ) A. 漏斗 B. 蒸发皿 C. 酒精灯 D. 玻璃棒 |
|
| 17. 选择题 | 详细信息 |
|
科学家刚刚发现了某种元素的一个原子,其质量是ag,12C的一个原子质量是bg,NA是阿伏加德罗常数的值,下列说法正确的是( ) A. 该原子的摩尔质量是aNA B. Wg该原子的物质的量是W/(aNA)mol C. Wg该原子中含有W/aNA个该原子 D. 由已知信息可得:NA=12/a |
|
| 18. 选择题 | 详细信息 |
|
下列元素不属于主族元素的是( ) A. 磷 B. 钙 C. 锌 D. 硅 |
|
| 19. 选择题 | 详细信息 |
|
下列各组离子中,因发生氧化还原反应而不能大量共存的是 A. K+、H+、Fe2+、MnO4- B. Fe3+、Ba2+、SO42-、NO3- C. Al3+、Na+、SO42-、CO32- D. Fe3+、H+、SO42-、ClO- |
|
| 20. 选择题 | 详细信息 |
|
下列说法中不正确的是( ) A. 化石燃料在任何条件下都能充分燃烧 B. 化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体 C. 直接燃烧煤不如将煤进行深加工后,再燃烧效果好 D. 固体煤变为气体燃料后,燃烧效率将更低 |
|
| 21. 选择题 | 详细信息 |
|
下列反应属于取代反应的是( ) A. CH4+2O2 C. NaCl+AgNO3===AgCl↓+NaNO3 D. CH2Cl2+Cl2 |
|
| 22. 选择题 | 详细信息 |
|
下列反应中不能得到氢氧化铝沉淀的是 ( ) A. 硫酸铝溶液与过量的氨水混合 B. 氯化铝溶液中加入几滴烧碱溶液 C. 偏铝酸钠溶液中加入过量的盐酸 D. 偏铝酸钠溶液中通入过量的二氧化碳 |
|
| 23. 选择题 | 详细信息 |
|
将10 g铁碳合金放入O2中高温灼烧,将反应后的气体通入到过量石灰水中得沉淀1.4 g.则此铁碳合金是( ) A. 生铁 B. 高碳钢 C. 中碳钢 D. 低碳钢 |
|
| 24. 选择题 | 详细信息 |
|
下列除去杂质(括号内的物质为杂质)的方法中错误的是 A. FeSO4(CuSO4):加足量铁粉后,过滤 B. CO (CO2):用NaOH溶液洗气后干燥 C. CO2(HCl):用NaOH溶液洗气后干燥 D. MnO2(KCl):加水溶解后,过滤、洗涤、烘干 |
|
| 25. 选择题 | 详细信息 |
|
下列叙述不正确的是( ) A. 氨易液化,液氨常用作制冷剂 B. 与金属反应时,稀硝酸可能被还原为更低价态,稀硝酸氧化性强于浓硝酸 C. 铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处 D. 稀硝酸和活泼金属反应时得不到氢气 |
|
| 26. 选择题 | 详细信息 |
|
下列有关化学实验安全问题的叙述中不正确的是( ) A. 闻化学药品的气味时都不能使鼻子凑近药品 B. 点燃可燃性气体之前要先检查纯度,以免发生爆炸 C. 金属钠着火时应使用干燥的沙土灭火 D. 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
|
| 27. 选择题 | 详细信息 |
|
下列关于“甲烷燃烧”的叙述中错误的是( ) A. 甲烷在空气中燃烧时火焰呈淡蓝色 B. 甲烷燃烧一定只生成二氧化碳和水 C. 甲烷燃烧放出大量的热,常用作气体燃料 D. 点燃甲烷前要先检验其纯度 |
|
| 28. | 详细信息 |
合成聚丙烯腈纤维的方法很多,如以乙炔为原料,其合成过程的化学反应方程式如下: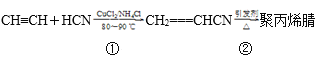 (1)反应①的反应类型为___。 (2)写出反应②的化学方程式:___,其反应类型为__。 (3)1mol合成聚丙烯腈的单体在一定条件下最多能与___molH2加成。 (4)CH2===CHCN在一定条件下可与苯乙烯( 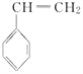 )反应得到一种优良的塑料,该塑料的结构简式为___。 )反应得到一种优良的塑料,该塑料的结构简式为___。 |
|
| 29. 实验题 | 详细信息 |
|
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。 (2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。 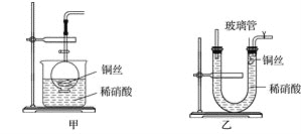 ①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。 A.铁 B.铝 C.铂 D.玻璃 ②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。 (3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。 ①长玻璃管的作用是______________________________________________________。 ②让反应停止的操作方法及原因是__________________________________________。 (4)以下收集NO气体的装置,合理的是________(填序号)。  (5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答: ①NO的体积为________ L,NO2的体积为________ L。 ②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。 |
|
| 30. 计算题 | 详细信息 |
H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。 (1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。 (2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。 (3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。 (4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。 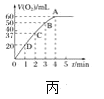 |
|
| 31. 推断题 | 详细信息 |
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断: (1)写出化学式:X_______,A________,B_______。 (2)实验室收集气体D和F的方法依次是_______法、________法。 (3)写出C→E的化学方程式:____________。 (4)请写出A与E反应生成D的化学方程式:_______________ (5)检验物质A的方法和现象是________________ |
|
| 32. 推断题 | 详细信息 |
如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。 请回答以下问题: (1)B是_____,D是_____,G是_____,H是_____(填化学式)。 (2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。 (3)A中元素的原子结构示意图为________。 (4)F在溶液中的电离方程式为_________。 (5)上述反应中属于氧化还原反应的是_______(填写序号)。 |
|
最近更新



