吉林2019年高三化学前半期在线免费考试
| 1. 选择题 | 详细信息 |
|
化学与人类生产、生活密切相关,下列叙述中不正确的是 A.用地沟油制取的生物柴油和从石油炼得的柴油都属于烃类物质 B.高铁“复兴号”车厢连接关键部位使用的增强聚四氟乙烯板属于高分子材料 C.“一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称,丝绸的主要成分是蛋白质,属于天然高分子化合物 D.中国天眼“FAST“,用到的碳化硅是一种新型的无机非金属材料 |
|
| 2. 选择题 | 详细信息 |
|
下列说法正确的是 A.在实验室用药匙取用粉末状或块状固体药品 B.pH试纸使用时不需要润湿,红色石蕊试纸检测氨气时也不需要润湿 C.蒸馏操作时,装置中的温度计的水银球应位于蒸馏烧瓶中的液体中部 D.分液时下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体从分液漏斗上端倒出 |
|
| 3. 选择题 | 详细信息 |
|
下列说法不正确的是 A.氯气是一种重要的化工原料,广泛应用于自来水的消毒和农药的生产等方面 B.钠和钾的合金在常温下是液体,可用于快中子反应堆作热交换剂 C.用硅制造的光导纤维具有很强的导电能力,可用于制作光缆 D.化肥的生产、金属矿石的处理、金属材料的表面清洗等都可能用到硫酸 |
|
| 4. 选择题 | 详细信息 |
|
下列叙述正确的是 A.天然气主要成分的结构式: C.漂白粉主要成分的化学式:Ca(ClO)2 D.苯的比例模型: |
|
| 5. 选择题 | 详细信息 |
|
对于反应A(g)+3B(g)=2C(g)+2D(g),以下表示中,反应速率最快的是 A.v(A)=0.8 mol/(L·s) B.v(B)=0.4 mol/(L·s) C.v(C)=0.6 mol/(L·s) D.v(D)=1.8 mol/(L·min) |
|
| 6. 选择题 | 详细信息 |
|
设NA表示阿伏加德罗常数的值,下列说法正确的是 A.标准状况下,11.2 L HF所含分子数为0.5NA B.2 mol NO与1 mol O2充分反应,产物的分子数小于2NA C.常温下,1 L 0.1 mol·L-1氯化铵溶液中加入氢氧化钠溶液至溶液为中性,则溶液含铵根离子数为0.1 NA D.已知白磷(P4)为正四面体结构,NA个P4与NA个甲烷所含共价键数目之比为1:1 |
|
| 7. 选择题 | 详细信息 |
关于下列各实验装置的叙述中,不正确的是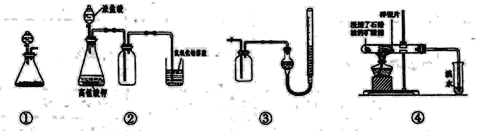 A.装置①可用于实验室制取少量NH3或O2 B.装置②可用于实验室制备Cl2 C.装里③可用从右侧管处加水的方法检验气密性 D.装置④中若溴水褪色则证明石蜡油分解产生乙烯 |
|
| 8. 选择题 | 详细信息 |
四元轴烯t,苯乙烯b及立方烷c的结构简式如下,下列说法正确的是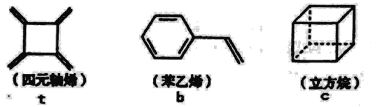 A.b的同分异构体只有t和c两种 B.t和b能使酸性KMnO4溶液褪色而c不能 C.t、b、c的二氯代物均只有三种 D.b中所有原子-定不在同-个平面上 |
|
| 9. 选择题 | 详细信息 |
|
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是其电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是 A. Y元素的最高价氧化物的水化物化学式为H2YO4 B. 它们形成的简单离子半径:X>W C. X、Z两种元素的气态氢化物稳定性:Z>X D. X与W形成的化合物中阴、阳离子个数比为1:1或1:2 |
|
| 10. 选择题 | 详细信息 | ||||||||||||||||||||
由下列实验对应的现象推断出的结论正确的是
|
|||||||||||||||||||||
| 11. 选择题 | 详细信息 | |||||||||||||||||||||||||||||||||||
用如图所示装置进行下述实验,下列说法正确的是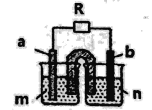
|
||||||||||||||||||||||||||||||||||||
| 12. 选择题 | 详细信息 |
|
下列离子方程式书写正确的是 A.小苏打治疗胃酸过多的反应:CO32-+2H+=CO2↑+H2O B.次氯酸钠溶液通入少通的CO2:2ClO-+CO2+H2O=2HClO+CO32- C.H218O2中加入H2SO4酸化的KMnO4:5H218O2+2MnO4-+6H+=518O2↑+2Mn2++8H2O D.过量SO2通入到Ba(NO3)2溶液中:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+ |
|
| 13. 选择题 | 详细信息 |
如图是l mol金属镁和卤素反应的△H(单位:kJ· mol-1)示意图,反应物和生成物均为常温时的稳定状态,下列选项中不正确的是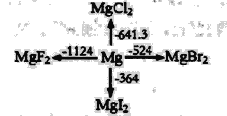 A.由图可知,MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ· mol-1 B.MgI2与Br2反应的△H<0 C.电解MgBr2制Mg是吸热反应 D.化合物的热稳定性顺序:MgI2>MgBr2>MgCl2>MgF2 |
|
| 14. 选择题 | 详细信息 |
|
固体粉末X中可能含有Fe、FeO、CuO、MnO2、KCl和K2CO3中的若干种。为确定该固体粉末的成分,某同学依次进行了以下实验: ①将X加入足量水中,得到不溶物Y 和溶液Z ②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物 ③用玻璃棒蘸取溶液Z滴于pH试纸上,试纸呈蓝色 ④向乙溶液中滴加AgNO3溶液,生成白色沉淀 分析以上实验现象,下列结论正确的是( ) A.X中一定不存在FeO B.Z溶液中一定含有K2CO3 C.不溶物Y中一定含有MnO2和CuO,而Fe与FeO中至少含有一种 D.向④中所生成的白色沉淀中滴加盐酸,若沉淀不完全溶解,则粉末X中含有KCl |
|
| 15. 综合题 | 详细信息 |
酿酒和造醋是古代劳动人民的智慧结晶,白酒和醋也是日常生活中常见的有机物。 (1)上述以高粱为主要原料的酿醋工艺中,利用醋酸溶解性的是_________(填选项)。 (2)写出乙酸在水溶液中的电离平衡常数的表达式________。 (3)已知25℃下,CH3COOH在水中电离的电离常数Ka=2×10-5,则25℃时CH5COONa水解平衡常数Kh=_________(填数值)。 (4)近年来,研究者利用乙酸开发出新工艺合成乙酸乙酯,使产品成本明显降低,其主要反应为: CH2=CH2 (g)+CH3COOH(l) ①该反应属于有机反应类型中的___________。 ②下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是_________(填选项)。 A 乙烯、乙酸、乙酸乙酯的浓度相同 B 酯化合成反应的速率与酯分解反应的速率相等 C 乙烯断开l mol碳碳双键的同时乙酸恰好消耗l mol D 体系中乙酸的百分含量一定 (5)下图为n(乙烯)与n(乙酸)物料比为1时,在不同压强下进行了乙酸乙酯的产率随温度变化的测定实验,在相同时间点的实验结果如图所示。回答下列问题: 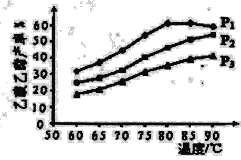 ①温度在60-80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是_______[用v(P1)、v(P2)、v(P3)分别表示不同压强下的反应速率]。 ②压强为P1 MPa、温度60℃时,若乙酸乙酯的产率为30%,则此时乙烯的转化率为_______。 ③压强为P1 MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________。 |
|
| 16. 实验题 | 详细信息 |
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。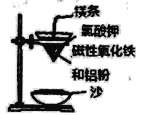 (l)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图)进行铝热反应,现象很壮观。使用镁条和氯酸钾的目的是___________。 (2)某同学取反应后的“铁块”和稀硝酸反应制备Fe(NO3)3溶液,其离子方程式为__________,溶液中可能含有Fe2+,其原因是___________; (3)可通过KClO溶液与Fe(NO3)3溶液的反应制备高铁酸钾(K2FeO4),如图所示是实验室模拟工业制备KClO溶液装置。已知氯气和热碱溶液反应生成氯化钾和氯酸钾和水 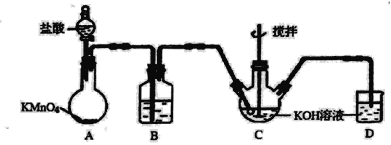 ①盛装饱和食盐水的B装置作用为______________; ②反应时需将C装置置于冷水浴中,其原因为___________; (4)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0 mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如图所示: ①终点II的读数为_______mL。 ②原样品中高铁酸钾的质量分数为_________。[M(K2FeO4)=198g/mol] ③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数_______(填“偏高”、“偏低”或“无影响”)。 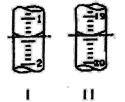 |
|
| 17. 综合题 | 详细信息 |
|
双氧水(过氧化氢的水溶液)在工业生产和日常生活中应用广泛。 (1)双氧水常用于伤口消毒,这一过程利用了过氧化氢的_________(填过氧化氢的化学性质)。 (2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。已知0.4 mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为__________。 (3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为________,写出该反应的离子方程式________。 (4)下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式_______。  (5)下图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。  ①Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式是_______。 ②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为__________mol。 |
|
| 18. 综合题 | 详细信息 |
|
(化学——选修3:物质结构与性质) 第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。 (1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为_______ (2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是_____。 (3)过渡金属可形成许多羧基配合物,即CO作为配体形成的配合物。 ①CO的等电子体有N2、CN-、_______等(任写一个)。 ②CO作配体时,配位原子是C而不是O,其原因是________。 (4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。 ①下列钒配合物中,钒原子满足18电子规则的是__________。 A [V(H2O)6]2+ B [V(CN)6]4- C [V(CO)6]- D [V(O2)4]3- ②化合物 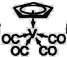 的熔点为138℃,其晶体类型为________。 的熔点为138℃,其晶体类型为________。(5)VCl2(熔点1027℃)和VBr2(熔点827℃)均为六方晶胞,结构如图所示。 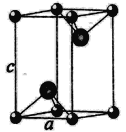 ①VCl2和VBr2两者熔点差异的原因是_________。 ②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为________(用含a、c、r+和r-的式子表示)。 |
|
| 19. 综合题 | 详细信息 |
|
[化学——选修5:有机化学基础] 具有抗菌作用的白头翁衍生物H的合成路线如图所示: 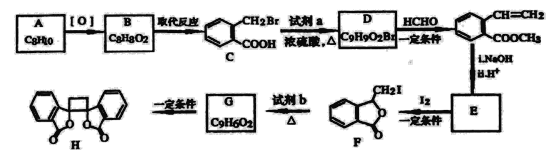 已知: Ⅰ:R′CH2Br Ⅱ: 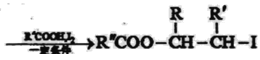 (1)A属于芳香烃,其名称是___________。 (2)写出符合下列条件的B的一种同分异构体:①苯环上只有一个取代基,②能发生银镜反应,③能发生水解反应,该物质的结构简式为___________。 (3)由C生成D的化学方程式是___________。 (4)由G生成H的反应类型是_________,1mol F与足量NaOH溶液反应,消耗__________mol NaOH。 (5)试剂b是_________。 (6)下列说法正确的是________(选填宇母序号) a G存在顺反异构体 b l mol G最多可以与1mol H2发生加成反应 c l mol H与足量NaOH溶液反应,消耗2mol NaOH (7) 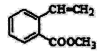 满足下面条件的同分异构体共有________种。 满足下面条件的同分异构体共有________种。①含有苯环 ②含有2个-CHO ③苯环上有两个取代基 |
|
最近更新



