秦皇岛市高二化学上册月考试卷试卷完整版
| 1. 选择题 | 详细信息 |
|
下列过程或现象与盐类水解无关的是( ) A. 纯碱溶液去油污 B. 铁在潮湿的环境下生锈 C. 加热氯化铁溶液颜色变深 D. 浓硫化钠溶液有臭味 |
|
| 2. 选择题 | 详细信息 |
|
下列溶液肯定呈酸性的是 A.含有H+离子的溶液 B.酚酞显无色的溶液 C.c(OH-)<c(H+)的溶液 D.pH小于7的溶液 |
|
| 3. 选择题 | 详细信息 |
|
醋酸在水中电离方程式可表示为: A.加入少量水 B.加热升温 C.加入锌粉 D.加入固体 |
|
| 4. 选择题 | 详细信息 |
|
一种充电电池放电时的电极反应为H2 + 2OH- - 2e- = 2H2O ;NiO(OH) + H2O + e- = Ni(OH)2 + OH-当为电池充电时,与外电源正极连接的电极上发生的反应是 A. H2O的还原 B. NiO(OH)的还原 C. H2的氧化 D. Ni(OH)2的氧化 |
|
| 5. 选择题 | 详细信息 |
|
用惰性电极电解下列物质的水溶液时,在阳极上不生成O2的是( ) A.NaOH B.H2SO4 C.ZnCl2 D.Na2SO4 |
|
| 6. 选择题 | 详细信息 |
|
将等物质的量的A、B混合于2L的恒容密闭容器中,发生如下的反应:3A(g )+B(g) A. 4 B. 3 C. 2 D. 1 |
|
| 7. 选择题 | 详细信息 |
某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是 A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl— B. 断开K2,闭合K1时,石墨电极附近溶液变红 C. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl— D. 断开K1,闭合K2时,石墨电极作正极 |
|
| 8. 选择题 | 详细信息 |
|
一种充电电池放电时的电极反应为H2 + 2OH- - 2e- = 2H2O ;NiO(OH) + H2O + e- = Ni(OH)2 + OH-当为电池充电时,与外电源正极连接的电极上发生的反应是 A. H2O的还原 B. NiO(OH)的还原 C. H2的氧化 D. Ni(OH)2的氧化 |
|
| 9. 选择题 | 详细信息 |
|
反应C(s)+H2O(g) ①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积增大 A. ①② B. ①③ C. ②③ D. ③④ |
|
| 10. 选择题 | 详细信息 |
下图中烧杯里盛的是海水,铁被腐蚀由快到慢的顺序是( ) A.③>②>①>⑤>④ B.④>②>①>③>⑤ C.③>②>④>⑤>① D.④>⑤>②>③>① |
|
| 11. 选择题 | 详细信息 |
|
下列反应中前者属于取代反应,后者属于加成反应的是( ) A.甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 B.乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 C.苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成; 乙烯与水生成乙醇的反应 D.在苯中滴入溴水,溴水褪色;乙烯自身生成聚乙烯的反应 |
|
| 12. 选择题 | 详细信息 |
|
下列叙述正确的是 A. 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 B. 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 C. 25℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 D. 0.1 mol AgCl和0.1 mol AgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
|
| 13. 选择题 | 详细信息 |
|
0.4mol CuSO4和0.4mol NaCl溶于水,配成1L溶液,用惰性电极进行电解,当—个电极得到0.3molCu时,另一个电极上生成的气体在标准状况下的体积是 A.5.6L B.6.72L C.1.344L D.11.2L |
|
| 14. 选择题 | 详细信息 |
下图为某二次电池充电时的工作原理示意图,该过程可实现盐溶液的淡化。下列说法错误的是( )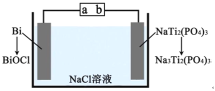 A.充电时,a 为电源正极 B.充电时, C.放电时,正极的电极反应为 D.充电时,新增入电极中的物质: |
|
| 15. 选择题 | 详细信息 |
|
室温下,下列说法正确的是 A.将 B.HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH大 C.向 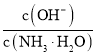 增大 增大D.将1 mL |
|
| 16. 选择题 | 详细信息 |
|
下列叙述中正确的是( ) A.25℃,Cu(OH) 2 在水中的溶度积常数比其在 Cu(NO3) 2 溶液中的大 B.一定温度下,将 0.10 mol/L的氨水加水稀释,溶液中各离子浓度均减小 C.用0.1mol/L的盐酸滴定0.1mol/L的氨水时,可用酚酞作指示剂 D.常温下,NaHS 溶液中:c(H+)+c(H2S)=c(S2-)+c(OH-) |
|
| 17. 选择题 | 详细信息 |
|
室温时,在由水电离出c(OH﹣)=1.0×10-12mol/L的溶液中,一定能大量共存的离子组是( ) A.K+、Na+、HCO3-、Cl- B.K+、MnO4-、Br-、Cl- C.Na+、Cl-、NO3-、SO42- D.Al3+、NH4+、Cl-、SO42- |
|
| 18. 选择题 | 详细信息 |
|
把A、B、C、D四块金属片浸入稀硫酸中,分别用导线两两相连可以组成原电池。A、B相连时A为负极;C、D相连时,电流由D→C;A、C相连时,C极上产生大量气泡,B、D相连时,D极发生氧化反应。这四种金属的活动性顺序是 A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A |
|
| 19. 选择题 | 详细信息 |
如图所示,甲池的总反应式为: N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( ) A. 该装置工作时,Ag电极上有气体生成 B. 甲池中负极反应为N2H4-4e-=N2+4H+ C. 甲池和乙池中的溶液的pH 均减小 D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g 固体 |
|
| 20. 综合题 | 详细信息 |
已知水在25℃和95℃时,其电离平衡曲线如图所示: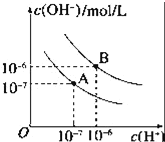 (1)95℃时水的电离平衡曲线应为___(填“A”或“B”).此温度下水的离子积KW=_____. (2)95℃时,0.01mol/LNaOH溶液的pH=_____. (3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______. (4)曲线B对应温度下,pH=2的某HA溶液中,由水电离出的氢离子浓度为_____mol/L. (5)若在水中加入少量MgCl2固体,则对水的电离有______作用。(填“促进”或“抑制”) |
|
| 21. 填空题 | 详细信息 |
如图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.  (1)甲池是 ______ 装置; (2)乙池中A(石墨)电极的名称是 ______ ; (3)写出通入CH3OH的电极的电极反应式: ______ ; (4)乙池中反应的化学方程式为 ______ ; (5)当乙池中B(Ag)极的质量增加4.32g时,甲池中理论上消耗O2 _____mL(标准状况);此时丙池某电极上析出1.60g某金属,则丙池中的某盐溶液可能是 ______ (填序号)。 A.MgSO4 B.CuSO4 C.NaCl D.AgNO3. |
|
| 22. 填空题 | 详细信息 |
|
乙二酸俗称草酸,为二元酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数K1=5.0×10-2,K2=5.4×10-5;碳酸的电离平衡常数K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题: (1)写出水溶液中草酸的电离方程式:________________________________。 (2)25℃,物质的量浓度都为0.1 mol/L的Na2C2O4溶液的pH比Na2CO3溶液pH______________________(填“大”“小”或“相等”)。 (3)常温下将0.2 mol/L的KOH溶液10 mL与0.2 mol/L的草酸溶液10 mL混合,若混合溶液显酸性,则该溶液中所有离子浓度由大到小的顺序:____________________。 (4)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入1.0×10-3mol/L的草酸钾溶液20 mL,能否产生沉淀?________________(填“能”或“否”)。 (5)除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理,而后用盐酸溶解,其反应的离子方程式:______________________________;________________________________。 |
|
| 23. 综合题 | 详细信息 | ||||||||
|
甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。 (1)工业上合成甲醇的反应为:CO(g)+2H2(g)
|
|||||||||
| 24. 实验题 | 详细信息 |
|
已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol。回答有关中和反应的问题。 (1)用0.1molBa(OH)2配成稀溶液与足量稀硝酸反应,能放出___kJ热量。 (2)如图装置中仪器A的名称___,作用是___;仪器B的名称___,作用是___;碎泡沫塑料的作用是___。  (3)若通过实验测定中和热的ΔH,其结果常常大于-57.3kJ/mol,其原因可能是___。 (4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得中和热的数值会___(填“偏大”、“偏小”或“无影响”)。 |
|
最近更新




