2019届初三下期中考一模化学题开卷有益(广东省广州市花都区)
| 1. | 详细信息 |
|
10月16日至25日,第七届全国城市运动会在江西省南昌市举行,在开幕式上的精彩表演中,发生化学变化的是( ) A. 焰火表演 B. 霓虹灯表演 C. 音乐喷泉 D. 气球升空 |
|
| 2. | 详细信息 |
|
2019年1月7日,特斯拉在上海的超级工厂开始动工,计划在2020年实现大规模生产。以下汽车配件中,属于合成材料的是( ) A. 牛皮座椅 B. 挡风玻璃 C. 塑料灯罩 D. 钢质骨架 |
|
| 3. | 详细信息 |
|
下列几组物质,按酸碱盐的顺序排列的是( ) A. HNO3、Na2CO3、BaSO4 B. Na2SO4、KOH、NaCl C. H2CO3、Ca(OH)2、MgO D. H2SO4、Ba(OH)2、Na2CO3 |
|
| 4. | 详细信息 |
|
下列关于空气的说法中,错误的是( ) A. 空气质量报告中所列的空气质量级别越小,空气质量越好 B. 空气中的稀有气体一般不跟其他物质反应,曾被称为“惰性气体” C. 空气中的CO2含量逐渐增多的主要原因为化石燃料的大量燃烧 D. 按质量计算,空气中约含氮气78%,氧气21%,其他气体和杂质约占1% |
|
| 5. | 详细信息 |
如图为某些粒子的结构示意图,下列说法错误的是( ) A. ①图表示原子,其中x的值9 B. 化学性质相似的原子是②④ C. 具有稳定结构的原子是② D. 属于同种元素的粒子是③④ |
|
| 6. | 详细信息 |
|
如图所示实验操作,正确的是( ) A.  测溶液pH B. 测溶液pH B.  过滤 过滤C.  稀释浓硫酸 D. 稀释浓硫酸 D.  量取9.3mL液体 量取9.3mL液体 |
|
| 7. | 详细信息 |
|
青少年要“珍爱生命,远离毒品”。“冰毒”﹣﹣甲基苯丙胺(C10H15N)具有强烈的兴奋和致幻效果。下列关于“冰毒”的叙述正确的是( ) A. 甲基苯丙胺属于有机物 B. 甲基苯丙胺分子的相对分子质量为149 g C. 甲基苯丙胺中氢元素的质量分数约为4.1% D. 甲基苯丙胺中C、H、N元素的质量比为10:15:1 |
|
| 8. | 详细信息 |
|
燃烧和火火的知识与我们的生活密切相关,下列认识错误的是( ) A. 氢气是理想的清洁燃料 B. 在加油站内可以随意接打手机 C. 调大燃气灶空气进气孔,使天然气充分燃烧 D. 火场逃生时在有烟雾的地方用湿毛巾捂住口鼻,匍匐前进逃离火场 |
|
| 9. | 详细信息 |
|
下列说法正确的是( ) A. 生活中常用蒸馏的方法将硬水进行软化 B. 将化肥氯化铵和草木灰(主要成分是碳酸钾)混合使用,可提高肥效 C. 同种溶质的饱和溶液一定比不饱和溶液浓 D. 配制50克5%的氯化钠溶液,量水时仰视读数,配得的溶液的溶质质量分数偏小 |
|
| 10. | 详细信息 |
|
下列应用和相应的原理(用化学方程式表示)及基本反应类型都正确的是( ) A. 金属铝放罝在空气中形成氧化膜 4A1 + 3O2 =2A12O3 氧化反应 B. 用氢氧化铝治疗胃酸过多症 A1(OH)3 +3HCl=A1Cl3 +H2O 复分解反应 C. 比较铜和银的活动性强弱 Cu +2AgCl = CuCl2 +2Ag 置换反应 D. 用盐酸除铁锈 Fe2O3 +6HC1=2FeCl3 +3H2O 复分解反应 |
|
| 11. | 详细信息 |
|
下列有关实验现象或事实叙述错误的是( ) A. 切完西瓜的菜刀洗浄擦干放在通风干燥处可以防止生锈 B. 用黄铜片(铜锌合金)和铜片相互刻划,铜片上留有划痕 C. 硫在空气中燃烧发出蓝紫色火焰,生成有刺激性气味的气体 D. 红磷在空气中燃烧,产生白烟 |
|
| 12. | 详细信息 |
|
下列化合物能由金属与酸发生置换反应直接制取的是( ) A. CuCl2 B. ZnCl2 C. FeCl3 D. AgCl |
|
| 13. | 详细信息 |
下列实验设计与结论对应关系正确的是( ) A. A B. B C. C D. D |
|
| 14. | 详细信息 |
|
已知甲、乙、丙三种物质的溶解度曲线如图所示,但不知它们分别对应哪条曲线。根据以下信息 (1)甲和乙不可能配制成相同浓度的饱和溶液 (2)甲和丙中有一种物质,其接近饱和的溶液可通过升温达到饱和 (3)将t2℃三种物质的饱和溶液降温到t1℃,乙的溶质质量分数大于丙 下列说法正确的是( )  A. 曲线Y代表丙 B. t1℃时,三种物质的溶解度大小为:甲>乙>丙 C. t2℃时,分别将X、Y的饱和溶液降温至t1℃,X析出的晶体一定比Y多 D. t2℃时,等质量的甲、乙、丙饱和溶液中,甲的溶质质量分数最小 |
|
| 15. | 详细信息 |
|
某些食物的近似pH为:牛奶6.3~6.6,葡萄3.5~4.5,玉米粥6.8~8.0,苹果2.9~3.3,其中酸性最强的是( ) A. 葡萄 B. 牛奶 C. 苹果 D. 玉米粥 |
|
| 16. | 详细信息 | ||||||||
下列知识整理的内容不完全正确的一组是( )
|
|||||||||
| 17. | 详细信息 |
|
下列各组物质的鉴别方法中正确的是( ) A. 用水鉴别CuSO4、NaOH、NH4NO3三种固体 B. 用燃着的木条鉴别O2、CO2、N2三种气体 C. 用灼烧的方法鉴别木炭粉、CuO、Fe3O4三种黑色粉末 D. 用酚酞溶液一次性鉴别H2SO4、KOH、NaCl三种溶液 |
|
| 18. | 详细信息 |
|
推理是化学学习中常用的思维方法.下列推理正确的是( ) A. NaOH溶液能与二氧化碳反应,则Cu(OH)2也能与二氧化碳反应 B. 分子能构成物质,所以原子、离子也能构成物质 C. 温度升高氧分子间隔增大,则温度升高水分子间隔也一定增大 D. 盐是由金属离子和酸根离子构成的,NH4NO3中没有金属离子,不属于盐 |
|
| 19. | 详细信息 | ||||||||||||||||||||
下列除去杂质所用的试剂和方法,正确的是( )
|
|||||||||||||||||||||
| 20. | 详细信息 |
|
请用化学用语填空: (1)两个铁离子_____。 (2)标出氧化铝中铝元素的化合价_____。 (3)最简单的有机物_____。 (4)空气中含量最多的气体_____。 |
|
| 21. | 详细信息 | |||||||
|
某同学对酸碱盐的知识进行了以下梳理 (1)请根据下表盐中的金属元素的排列顺序,填写空格中的化学式:
|
||||||||
| 22. | 详细信息 |
如图实验所示是酸碱中和反应的实验研究 (1)滴加稀盐酸前。烧杯中溶液呈_____色。随着稀盐酸不断滴入溶液呈无色。为探究反应后稀盐酸是否过量,可选用的试剂有_____(填选项,多选) A Ca(OH)2 B 锌粒 C 碳酸钠 D 紫色石蕊溶液 (2)随着盐酸不断滴入,烧杯中溶液的pH逐渐_____(填“增大“减小”或“不变”) (3)随着盐酸不断滴入,烧杯中溶液温度变化如坐标图2所示,根据图象可以判断中反应是_____反应(填“放热”或“吸热”) (4)图2中c点表示的含义是_____;b点溶液中含有的阳离子有_____; (5)图3是NaOH和稀HCl反应的示意图,用化学反应方程式表示为_____。从该图可以看出,反应前后微粒数目减少的有_____。 |
|
| 23. | 详细信息 | ||||||
以焦炭和碳酸钙为原料生产碳化钙( CaC2 ),并制备重要工业原料乙炔( C2 H2 )气体, 其工艺流程如下图: (1)写出碳酸钙分解的化学方程式_____。 (2)将氧化钙和焦炭反应的化学方程式补充完整, CaO + C CaC2 CO ;生成的 CO 不能排放到空气中,是因为_____。 (3)猜想:固体 A 的成分可能是氢氧化钙或碳酸钙。 设计实验证明猜想。
|
|||||||
| 24. | 详细信息 |
|
过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域,特别是鱼苗在长途运输中,通常将鱼苗养在相对密闭的容器内,在容器内满足下列条件才能保持鱼存活:充足的氧气;及时除去鱼呼出的CO2,容器中的水要呈弱碱性。加入过氧化钙后,就可以解决这些问题。 (1)过氧化钙(CaO2)中的氧元素的化合价为_____。 (2)过氧化钙的供氧原理是过氧化钙可以与水反应生成氧气和氢氧化钙,请写出过氧化钙与水反应的化学方程式_____。 (3)小明想在实验室用过氧化钙固体与水反应制取氧气。实验过程中发现过氧化钙与水反应“开始有较多细小气泡放出,随后放出气泡的速咸缓”,原因可能是_____。 (4)如图是以大理石(含A12O3及其他不溶于水也不溶于酸的杂质)等为原料制取CaO2的流程图  ①操作a、b、c的名称都为_____。 ②从滤液C中可回收的副产品的化学式为_____,属于_____肥。 ③写出反应①的化学方程式_____。 ④反应②是在低温下往过氧化氢浓溶液中投入无水氯化钙进行反应,该反应的化学方程式为_____,基本反类型是_____。 ⑤在该生产过程中,用110kg的大理石制得了72kg的过氧化钙,如果不考虑过程中的损耗可计算出大理石中CaCO3的质量分数为_____(结果保留一位小数) |
|
| 25. | 详细信息 |
实验室有如图所示装置,回答下列问题。 (1)填写仪器名称:Y_____;X_____。 (2)检查装置A气密性的操作和现象是:先_____,向X中加水至形成一段水柱,静置,观察到水柱高度不变,说明气密性良好。 (3)B是制取蒸馏水的简易装置。烧杯中冷水的作用是_____。 |
|
| 26. | 详细信息 |
实验室里现有氯酸钾、二氧化锰、石灰石、稀盐酸和稀硫酸,以及以下仪器: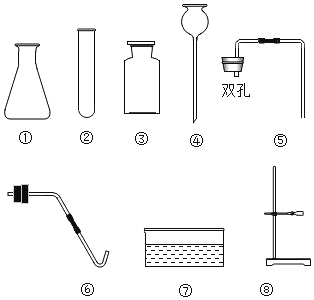 (1)请写出图中②的仪器名称:___。 (2)利用上述仪器和药品可以制取CO2,你选择的仪器是___(填序号),药品是___。检验二氧化碳气体的方法是___(用化学方程式表示)。碳在氧气中完全燃烧也能生成CO2,该方法不能用于实验室制取CO2的原因是___。 (3)若补充一种仪器___(填仪器的名称),再利用上述仪器和药品还可以制取氧气,反应的化学方程式是___。 |
|
| 27. | 详细信息 |
某同学配制50g 6%氯化钠溶液,整个操作过程如图所示,回答下列问题: (1)配制溶液的正确操作顺序为_____(填序号,下同),其中操作错误的是_____; (2)图②中盛放氯化钠固体的仪器名称是_____。 (3)量水时选用的量筒的量程最合适的是_____(填序号) A 10mL B 25mL C 50mL D 100mL (4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是_____(填序号)。 A 氯化钠固体不纯 B 用生锈砝码称量 C 装瓶时有少量溶液洒出 D 溶解时烧杯内壁有水珠 |
|
| 28. | 详细信息 |
进行如下微型实验,研究物质的性质。 (1)A中无色酚酞溶液变为红色,证明碳酸钠溶液显_____性。 (2)B中产生大量气泡的原因是_____(用化学方程式解释)。 (3)碳酸钠溶液在鉴别C、D中的物质时,依据的不同现象是_____。 (4)E中发生复分解反应,产生白色沉淀,其反应的化学方程式为_____。 |
|
最近更新





