2019-2020年高二上册期中考试化学试卷(黑龙江省哈尔滨师范大学附属中学)
| 1. 选择题 | 详细信息 |
|
下列各组物质全部是弱电解质的是 A.H2SiO3、H2S、CO2 B.Cu(OH)2、 CH3COOH、C2H5OH C.H2SO3、Ba(OH)2、BaSO4 D.H2O、NH3·H2O、H3PO4 |
|
| 2. 选择题 | 详细信息 |
|
下列有关问题,与盐的水解有关的是 ①草木灰与铵态氮肥不能混合施用 ②用热的纯碱溶液去除油污 ③实验室保存氯化亚铁溶液应加入少量铁屑 ④用NaHCO3和Al2(SO4)3两种溶液做泡沫灭火器 A.①②③ B.②③④ C.①②④ D.①③④ |
|
| 3. 选择题 | 详细信息 |
|
NA表示阿伏加德罗常数的值,以下说法正确的是 A.常温下pH=13的Ba(OH)2溶液中含有Ba2+数目为0.05NA B.工业合成氨的反应中,每生成3NA H―H键的同时生成6NA N―H键,反应达到平衡状态 C.100mL 1.0mol/L NaHCO3溶液中的HCO3-数目为0.1 NA D.用惰性电极电解CuSO4溶液,外电路中通过电子数目为NA时,阳极产生5.6L气体 |
|
| 4. 选择题 | 详细信息 |
|
对于可逆反应:A2(g)+3B2(g) A.  B.  C. 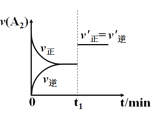 D.  |
|
| 5. 选择题 | 详细信息 |
CH3COONa稀溶液中分别改变如下条件,能使比值 一定减小的是 一定减小的是①固体NaOH;②少量冰醋酸;③固体NaHSO4;④固体CH3COONa;⑤降温; A.①③ B.①④ C.②⑤ D.③④ |
|
| 6. 选择题 | 详细信息 |
25℃,以0.10mol/LNaOH溶液滴定20.00mL醋酸溶液和20.00mL盐酸,滴定曲线如图所示,下列说法不正确的是 A.曲线Ⅰ、Ⅱ分别表示醋酸溶液和盐酸的滴定曲线 B.达到滴定终点时,两溶液pH均等于7 C.初始时盐酸的浓度为0.10mol/L D.滴定醋酸溶液、盐酸时,均可选择酚酞溶液做指示剂 |
|
| 7. 选择题 | 详细信息 |
|
常温时,下列各组溶液中的离子一定能够大量共存的是 A.由水电离出的c(H+)=1.0×10-13mol/L的溶液中:Na+、Cl-、NH4+、S2O32- B.含有大量的AlO2-溶液中:K+、Na+、CO32-、HCO3- C.c(H+)=1.0×10-13mol/L的溶液中:Na+、S2-、SO32-、SO42- D.使甲基橙试液变红的溶液中:Fe2+、Mg2+、NO3-、Cl- |
|
| 8. 选择题 | 详细信息 |
在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应 CO2(g)+C(s) A. 反应 CO2(g)+C(s) B. 体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ) C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) D. 逆反应速率v逆::v逆(状态Ⅰ)>v逆(状态Ⅲ) |
|
| 9. 选择题 | 详细信息 |
|
下列事实一定能说明HF是弱电解质的是 ①常温下NaF溶液的pH大于7; ②用氢氟酸做导电实验,灯泡很暗; ③1mol/L的氢氟酸能使紫色石蕊试液变红; ④常温下,0.1mol/L氢氟酸的pH为2.3 ⑤向NaF溶液中加入H3PO4溶液,反应生成HF A.①④⑤ B.②③⑤ C.①③④ D.①②④ |
|
| 10. 选择题 | 详细信息 |
|
下列叙述正确的是 A.将pH= a醋酸溶液稀释到原体积的2倍后,溶液的pH=b,则a>b B.在滴有酚酞溶液的氨水中,加入NH4Cl固体至溶液恰好无色,则此时溶液的pH<7 C.1.0×10-3mol/L盐酸的pH=3,1.0×10-8mol/L盐酸的pH=8 D.25℃,若1mL pH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则该NaOH溶液pH=11 |
|
| 11. 选择题 | 详细信息 |
|
下列说法不正确的是 A.增加反应物浓度可增大单位体积的活化分子数,活化分子百分数保持不变 B.升高温度可以增大活化分子百分数,从而加快化学反应速率 C.压缩容器容积增大压强,活化分子百分数增大,从而加快任一反应的化学反应速率 D.催化剂可以降低反应所需的活化能,活化分子百分数增大 |
|
| 12. 选择题 | 详细信息 |
|
某温度下,相同物质的量浓度的下列溶液中,①NH4Cl;②NH3·H2O;③CH3COONH4;④NH4Al(SO4)2。c(NH4+)由大到小的顺序是 A.③①④② B.④①③② C.①④③② D.④③①② |
|
| 13. 选择题 | 详细信息 |
|
在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3;②Na2CO3;③KCl;④CuCl2;⑤CH3COONH4;⑥Na2SO3;可得到相应盐的晶体(可含结晶水)的是 A.①②③ B.①③⑥ C.②⑤⑥ D.③④⑤ |
|
| 14. 选择题 | 详细信息 | |||||||||||||||
由下列实验及现象能推出相应结论的是
|
||||||||||||||||
| 15. 选择题 | 详细信息 |
|
常温下,体积相同、物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液pH分别为7、9、10,则下列说法不正确是 A.酸性强弱:HX>HY>HZ B.配制等pH的NaY、NaZ两溶液:c(NaY)>c(NaZ) C.三种溶液的离子总数相同 D.稀释上述三种溶液后,各离子浓度不一定都减小 |
|
| 16. 选择题 | 详细信息 |
|
已知25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是 A.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中Ksp比在20 mL 0.01 mol/LNH4Cl溶液中Ksp小 B.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 C.25℃时,在MgF2悬浊液中加入NaOH溶液后,MgF2不可能转化为Mg(OH)2 D.25℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
|
| 17. 选择题 | 详细信息 |
25℃、101kPa条件下,在一个容积可变的密闭容器中加入一定体积的NO2气体发生反应2NO2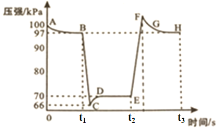 A.B点N2O4的物质的量分数为97% B.H点对应的容器内气体颜色比E点的深 C.C点的正、逆反应速率大小:v正<v逆 D.B、E两点的混合气体平均摩尔质量大小:M(B)>M(E) |
|
| 18. 选择题 | 详细信息 |
常温下,现有0.1mol/LNH4HCO3溶液,溶液pH为7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示。下列说法不正确的是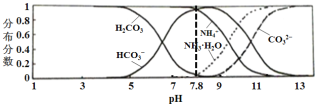 A.NH4HCO3溶液中存在下列关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) B.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-) C.向该溶液中加入少量氢氧化钠固体时,c(HCO3-)、c(NH4+)均减小 D.通过分析可知常温下Kb(NH3·H2O)<Ka1(H2CO3) |
|
| 19. 选择题 | 详细信息 | ||||||||||||||||||||||||
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,发生反应N2(g)+3H2(g)
|
|||||||||||||||||||||||||
| 20. 选择题 | 详细信息 | ||||||||
25℃时,三种弱酸的电离平衡常数如下表所示,下列说法正确的是
|
|||||||||
| 21. 计算题 | 详细信息 |
|
完成下列计算: (1)25℃,0.1mol/L NaOH溶液中的c(H+)=________,稀释该溶液到原体积的100倍,水电离出的c(OH-)的浓度为__________________; (2)25℃,pH=13的NaOH溶液中的c(OH-)是pH=11的NaOH溶液中的c(OH-)的______倍,将这两种NaOH溶液等体积混合后的溶液pH为___________(lg2≈0.3,lg3≈0.5,lg5≈0.7,忽略溶液体积变化); (3)25℃,等物质的量浓度的NaOH溶液与盐酸按3:2体积比混合,所得溶液的pH为12,则NaOH溶液与盐酸的初始浓度为________________(忽略溶液体积变化)。 |
|
| 22. 综合题 | 详细信息 | ||||||||||||||||||||
|
工业上常用甲烷与水蒸气的催化重整反应制取水煤气。T℃时,每生成5.6gCO该反应吸热40.6kJ。 (1)该反应的热化学方程式为_____; (2)该反应的逆反应速率方程为v逆=k逆·cm (CO)·cn (H2), k逆、m、n需要通过实验测定。T℃时,测得有关数据为:
|
|||||||||||||||||||||
| 23. 综合题 | 详细信息 |
CrO42-和Cr2O72-在溶液中可相互转化。室温下,1.0×10-3mol/L的Na2CrO4溶液中c(Cr2O72-)随pH的变化如图所示。 (1)用离子方程式表示Na2CrO4溶液中的可逆反应________________。 (2)调节该溶液的酸碱性使pH减小,观察到实验现象为_______________根据图示中A点数据,计算出该转化反应的平衡常数________; (3)温度升高,溶液中CrO42-的平衡转化率减小,则该反应的ΔH____0(填“大于”、“等于”或“小于”)。 (4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定待测液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,作为滴定终点标志。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为____ mol/L,此时溶液中c(CrO42-)等于____ mol/L。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。 |
|
| 24. 实验题 | 详细信息 | |||||||||||||||||
|
为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下: ①称取1.260g草酸晶体,配成100mL溶液。 ②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。 ③用浓度为0.1000mol/L的KMnO4溶液滴定H2C2O4溶液,当_________________时,滴定结束。 ④记录数据,重复实验。整理数据如下:
|
||||||||||||||||||
| 25. 计算题 | 详细信息 |
|
20℃,每100g水仅能溶解0.148gCa(OH)2。CaCO3在水中达到溶解平衡时,其Ksp为8.0×10-9(溶液密度近似为1g/cm3)。 (1)计算20℃时Ca(OH)2饱和溶液中的c(OH-);_________ (2)在10 mL Ca(OH)2饱和溶液中加入10mL0.10mol/L的K2CO3溶液,忽略溶液体积变化,通过计算判断是否生成CaCO3沉淀_________,并求此时溶液中c(Ca2+)。__________ |
|




