上海市崇明区2020届高三第二次模拟化学试卷
| 1. 选择题 | 详细信息 |
|
下列化学名词正确的是( ) A.焦碳 B.硫黄 C.风化 D.饱合 |
|
| 2. 选择题 | 详细信息 |
|
化学反应类型很多,下列反应类型间关系的图示中错误的是( ) A.  B. B. C.  D. D. |
|
| 3. 选择题 | 详细信息 |
|
氢元素的下列微粒中,含质子、中子和电子的数目之和最大的是( ) A.H2 B.HD C.T+ D.D- |
|
| 4. 选择题 | 详细信息 |
|
向盛有下列固体的试管中逐滴加入盐酸至过量,盐酸只发生一个化学反应的是( ) A.硝酸银 B.生锈的铁 C.碳酸钠 D.次氯酸钠 |
|
| 5. 选择题 | 详细信息 |
等物质的量的桂皮酸(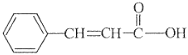 ),在一定条件下分别与溴水、氢气、碳酸氢钠溶液和乙醇反应时,消耗物质的量最小的是( ) ),在一定条件下分别与溴水、氢气、碳酸氢钠溶液和乙醇反应时,消耗物质的量最小的是( )A.Br2 B.H2 C.NaHCO3 D.CH3CH2OH |
|
| 6. 选择题 | 详细信息 |
对如图所示的实验装置中各部分仪器的主要作用的叙述正确的是( ) A.大烧杯d:防止在a发生破裂后使药品外溢 B.量气管b:读出反应前后与水面相平的刻度 C.水准管c:可方便地向整个装置中添加液体 D.温度计e:搅拌烧杯中的液体并且测量温度 |
|
| 7. 选择题 | 详细信息 |
|
有关物质结构概念的判断正确的是( ) A.离子键:阴阳离子间的静电吸引作用 B.离子化合物:只含离子键的物质 C.共价键:通过共用电子对产生的作用 D.共价化合物:含有共价键的物质 |
|
| 8. 选择题 | 详细信息 |
|
关于矿石燃料的使用的叙述错误的是( ) A.煤干馏分解成焦炭、煤焦油、粗氨水和焦炉气 B.石油分馏成多种混合物 C.石油裂化或裂解可以得到轻质油和乙烯等产品 D.煤的液化变成人造石油 |
|
| 9. 选择题 | 详细信息 |
已知H2+Cl2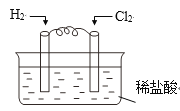 A.负极 B.正极 C.阴极 D.阳极 |
|
| 10. 选择题 | 详细信息 |
|
亚硝酸亚铁Fe(NO2)2易分解,若分解产物之一是红色粉末Fe2O3,则另一分解产物可能是( ) A.NO B.N2O3 C.NO2 D.N2O5 |
|
| 11. 选择题 | 详细信息 |
与反应C+CO2    A.① B.②④ C.③ D.①③ |
|
| 12. 选择题 | 详细信息 |
|
下列相关实验的叙述中正确的是( ) A.在胆矾溶液中滴入少许烧碱溶液,再加入有机物加热可验证含醛基类物质 B.实验室测定硫酸铜晶体中结晶水含量时,需要进行的称量操作一定为4次 C.为验证氯乙烷中含氯,将其与氢氧化钠溶液混合加热后再滴入硝酸银溶液 D.需要约480mL0.100mol/L的NaOH溶液,配制时可准确称量NaOH2.000g |
|
| 13. 选择题 | 详细信息 |
|
向盐酸中滴入浓硫酸会产生白雾,对此现象的解释不合理的是( ) A.浓硫酸具有吸水性 B.浓硫酸具有脱水性 C.浓盐酸具有挥发性 D.氯化氢极易溶于水 |
|
| 14. 选择题 | 详细信息 |
|
对溶液中下列离子进行检验,正确的操作是( ) A.NH4+:取样,加入氢氧化钠溶液,即产生使湿润红色石蕊试纸变蓝的气体 B.SO42-:取样,加入足量的盐酸无现象,再滴入氯化钡溶液有白色沉淀产生 C.Fe2+:取样,滴入硫氰化钾溶液无现象,再加入过量的氯水,溶液呈血红色 D.Cl-:取样,滴入硝酸银溶液产生白色沉淀,再加入过量的硫酸沉淀不消失 |
|
| 15. 选择题 | 详细信息 |
|
下列化工生产与该生产过程中使用的一些生产工艺不相符的是( ) A.氢气和氯气制盐酸——催化和气循环 B.氢气和氮气合成氨——压缩和水冷却 C.联合制碱法制纯碱——过滤和热灼烧 D.二氧化硫接触氧化——催化和热交换 |
|
| 16. 选择题 | 详细信息 |
如图所示,硫酸铁与M、N、P、Q反应产生不同的现象。则各符号对应的试剂错误的是( ) A.M:硫氰化钾溶液 B.N:铁粉 C.P:氢氧化钡溶液 D.Q:氨水 |
|
| 17. 选择题 | 详细信息 | ||||||||||||||||||||
为提纯物质(含括号内的杂质少量),所选用试剂及实验方法均正确的是( )
|
|||||||||||||||||||||
| 18. 选择题 | 详细信息 |
|
能在溶液中大量共存,且各离子的物质的量浓度相同(忽略离子的水解)的一组是( ) A.Mg2+、K+、NH4+、CO32-、SO42- B.Fe2+、H+、NO3-、Cl-、S2- C.Al3+、Na+、SO42-、Cl-、NO3- D.Cu2+、H+、SO42-、Cl-、NO3- |
|
| 19. 选择题 | 详细信息 | ||||||
M、N、W、K四种元素在元素周期表中的位置如图所示。已知W原子的最外层电子构型为nsnnp2n。则下列叙述正确的是( )
|
|||||||
| 20. 选择题 | 详细信息 |
|
25℃时,用蒸馏水稀释10mLpH=11的氨水。下列叙述正确的是( ) A.该10mL氨水的浓度为0.001mol/L B.稀释至100mL时,溶液的pH小于10 C.稀释时,溶液中所有的离子的浓度均变小 D.稀释过程中, |
|
| 21. 综合题 | 详细信息 |
|
在实验室可以将硫化氢气体通入装有硫酸铜溶液的洗气瓶中而将其吸收。现象是洗气瓶中产生黑色沉淀,同时蓝色溶液逐渐变浅而至无色。完成下列填空: (1)写出发生反应的化学方程式___,该反应能够发生是因为(选填编号)___。 A.强酸生成了弱酸 B.强氧化剂生成了弱还原剂 C.生成的黑色沉淀不溶于水,也不溶于一般的酸 D.生成的无色溶液不能导电,也不能挥发出气体 (2)该反应体系中的属于弱电解质的溶液,跟含有与该弱电解质等物质的量的氢氧化钠的溶液混合发生反应后,混合溶液中存在的离子一共有___种,这些离子的浓度大小不同,其中浓度第二大的离子的符号是___,从物料平衡的角度溶液中c(Na+)=___。 (3)硫化铜与一般酸不反应,但可与浓硝酸发生反应:___CuS+___HNO3(浓)—___CuSO4+___NO2↑+___H2O,配平此反应方程式,将系数填写在对应的横线上。 (4)若反应中转移1.6mol电子时,则产生的气体在标准状况下体积为___L;若反应的氧化产物为0.8mol时,则反应中转移电子数为___。 (5)此反应体系中的含硫物质形成的晶体类型为___,此反应体系中非金属元素的原子半径由大到小的是(用元素符号表示)___。 |
|
| 22. | 详细信息 |
|
工业制取皮革加工中的鞣化剂硝酸铝,是用铝灰与烧碱、硝酸反应制得的。铝灰是铝、氧化铝和氧化铁的混合物。产品硝酸铝晶体为Al(NO3)3·nH2O。 已知偏铝酸盐能与一般的酸反应,如:NaAlO2+HNO3+H2O→NaNO3+Al(OH)3↓ 生产流程如图:  完成下列填空: (1)用氢氧化钠固体配制30%的氢氧化钠溶液,除烧杯、玻璃棒外还需(选填编号)___。 A.  B. B. C. C. D. D. 说出流程中产生的滤渣的一种用途是___。制作一个过滤器需要___。流程中操作x的名称是____。 (2)反应Ⅱ加入的硝酸必须适量,原因是___。反应Ⅲ加入的硝酸要稍过量,原因是___。 (3)从反应Ⅲ所得的溶液制成产品的步骤依次为减压蒸发,___,过滤,___,低温烘干。 (4)为测定所得的产品的纯度,质检人员称取产品Wg,溶于水配成500mL溶液,从中取出25.00mL,加入过量已知浓度的氨水充分反应后,剩余的氨水用已知浓度的盐酸溶液进行测定。通过计算便可得出产品的纯度。 ①上述过程属于定量实验。其中除配制一定物质的量浓度的溶液外,还有一个是___,该实验过程中要进行多次读数,读数的方法是读出与___的刻度值。 ②任意写出一个该测定过程中所涉及的化学反应的离子方程式:___。 |
|
| 23. 推断题 | 详细信息 |
用常见烃A与某些烃的含氧衍生物可以制备PI(聚2-甲基-1,3-丁二烯)和PVB塑料。流程如图: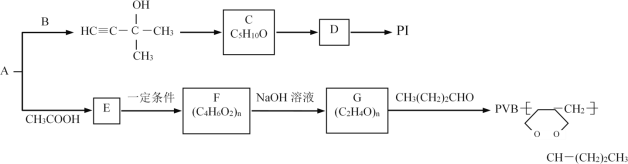 完成下列填空: (1)A的名称是___,B的结构简式为___,C→D的反应条件是___,D→PI的反应类型是___。 (2)E中所含官能团的名称是___,写出符合下列条件的E的所有同分异构体的结构简式:___。 a.能发生银镜反应和水解反应 b.能与氢气发生加成反应 c.分子结构中含有一个甲基 (3)写出F→G的化学反应方程式:___。 (4)试用电石和乙醛等原料(无机试剂任选)制取1,3-丁二烯(合成正丁橡胶的原料),写出合成路线___。 (合成路线常用的表示方式为:A |
|
| 24. 综合题 | 详细信息 |
|
我国十分重视保护空气不被污染,奔向蓝天白云,空气清新的目标正在路上。硫、氮、碳的大多数氧化物都是空气污染物。完成下列填空: I.(1)碳原子的最外层电子排布式为___。氮原子核外能量最高的那些电子之间相互比较,它们不相同的运动状态为___。硫元素的非金属性比碳元素强,能证明该结论的是(选填编号)___。 A.它们的气态氢化物的稳定性 B.它们在元素周期表中的位置 C.它们相互之间形成的化合物中元素的化合价 D.它们的最高价氧化物对应水化物的酸性强弱 Ⅱ.已知NO2(g)+SO2(g) (2)在一定条件下,容器中压强不发生变化时,___(填“能”或“不能”)说明该反应已经达到化学平衡状态,理由是:___。 在一定温度下,若从反应体系中分离出SO3,则在平衡移动过程中(选填编号)___。 A.K值减小 B.逆反应速率先减小后增大 C.K值增大 D.正反应速率减小先慢后快 Ⅲ.化学家研究利用催化技术进行如下反应:2NO2+4CO (3)写出该反应体系中属于非极性分子且共用电子对数较少的物质的电子式___。按该反应正向进行讨论,反应中氧化性:___>___。 若该反应中气体的总浓度在2min内减少了0.2mol/L,则用NO2来表示反应在此2min内的平均速率为___。 (4)已知压强P2>P1,试在图上作出该反应在P2条件下的变化曲线___。  该反应对净化空气很有作用。请说出该反应必须要选择一个适宜的温度进行的原因是:___。 |
|
最近更新



