山东省实验中学2020届高三上册第二次诊断考试化学免费试卷
| 1. 选择题 | 详细信息 |
|
下列关于物质性质的说法不合理的是 A.FeC13、Na2O2、Cu2S均可由相应单质直接化合生成 B.C12、SO2气体通入紫色石蕊试液中,均出现溶液先变红后褪色 C.金属Mg与稀硫酸和CO2均能反应,其反应类型相同 D.氢氧化铝、碳酸铵、碳酸氢钠都既能与盐酸反应,又能与氢氧化钠溶液反应 |
|
| 2. 选择题 | 详细信息 | ||||||||||||||||||||
化学在生产、生活中有着重要用途,下列对物质的用途、解释都正确的是
|
|||||||||||||||||||||
| 3. 选择题 | 详细信息 |
|
下列有关说法正确的是 A.存在化学键断裂的变化一定是化学变化 B.酸性氧化物不一定是非金属氧化物,碱性氧化物都是金属氧化物 C.纳米铁粉可以高效地去除被污染水体中的pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附 D.石油的分馏和煤的气化、液化均为物理变化 |
|
| 4. 选择题 | 详细信息 |
|
下列依据热化学方程式得出的结论正确的是 A.己知:正丁烷(g)=异丁烷(g) △H<0,则正丁烷比异丁烷稳定 B.己知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H=-1478.8k·mol-1,则C2H4的燃烧热△H=-1478.8kJ·mol-1 C.己知:H+(aq)+OH-(aq)==H2O(1) △H=-57.3kJ· mol-1,但稀Ba(OH)2(aq)和稀H2SO4(aq)完全反应生成1molH2O(1)时,放出的热量大于57.3kJ D.已知:S(g)+O2(g)==SO2(g) △H1;S(s)+O2(g)==SO2(g) △H2,则△H1>△H2 |
|
| 5. 选择题 | 详细信息 |
|
下列有关说法正确的是( ) A.实验室制氢气,为了加快反应速率,可向稀 H2SO4 中滴加少量 Cu(NO3)2 溶液 B.N2(g)+3H2(g) C.吸热反应“TiO2(s)+2Cl2(g) =TiCl4(g)+O2(g)”一定条件下可自发进行,则该反应ΔS<0 D.在稀AgNO3溶液中加入过量 NaCl溶液,产生白色沉淀,再加入少量 Na2S溶液,出现黑色沉淀,则加入Na2S溶液后 c(Ag+) 更小了 |
|
| 6. 选择题 | 详细信息 |
|
设NA代表阿伏加德罗常数的值。下列说法正确的是 A.25℃,1LpH=13的氢氧化钡溶液中含OH-的数目为0.2NA B.12.0gNaHSO4晶体中阳离子和阴离子的总数为0.3NA C.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA D.4.2gCaH2与水完全反应,转移的电子数为0.1NA |
|
| 7. 选择题 | 详细信息 |
|
下列指定反应的离子方程式正确的是 A.氢氧化镁与硫酸的反应:OH-+H+=H2O B.过量的铁粉溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O C.用氨水吸收过量的二氧化硫:OH-+SO2=HSO3- D.向0.5mol·L-1KAl(SO4)2溶液中滴入0.5mol·L-1Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++4OH-+A1 3++2SO42-=2BaSO4↓+A1O2-+2H2O |
|
| 8. 选择题 | 详细信息 |
|
常温下,下列各组离子一定能在指定溶液中大量共存的是( ) A. c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、SO42- B. 滴加KSCN溶液显红色的溶液中:NH4+、K+、Cl-、I- C. 0.1mol·L-1的NaHCO3溶液中:Fe3+、K+、Cl-、SO42- D. 水电离产生的c(OH-)=10-12 mol·L-1的溶液中:Na+、Al3+、Cl-、NO3- |
|
| 9. 选择题 | 详细信息 |
|
雌黄(As2S3)在我国古代常用作书写涂改修正胶。浓硝酸氧化雌黄可制得硫黄,并生成砷酸(H3AsO4)和一种红棕色气体,利用此反应原理设计为某原电池。下列有关叙述正确的是 A.该反应中被氧化的元素只有S B.该反应中每析出4.8g硫黄,则转移0.5mol电子 C.该反应的氧化剂和还原剂物质的量之比为6:1 D.红棕色气体在该原电池的负极区生成并逸出 |
|
| 10. 选择题 | 详细信息 |
|
某混合溶液中含有NaI、NaBr、Na2SO3三种溶质,其物质的量均为l mol,向混合溶液中通入一定量的氯气。下列说法正确的是 A.将溶液蒸干最多可以得到4 mol NaCl B.将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4 C.向溶液中滴加KI淀粉溶液,溶液变蓝,则氯气一定过量 D.若通入氯气的体积为11.2 L(标准状况),反应的离子方程式为:2I-+Cl2=I2+2C1- |
|
| 11. 选择题 | 详细信息 |
4.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝: 下列说法中错误的是( ) A. ①②中除加试剂外,还需要进行过滤操作 B. a、b中铝元素的化合价相同 C. ③中需要通入过量的氨气 D. ④进行的操作是加热,而且d一定是氧化铝 |
|
| 12. 选择题 | 详细信息 |
常温下,将pH和体积均相同的HNO2和CH3COOH溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是 A.电离平衡常数:Ka(CH3COOH)>Ka(HNO2) B.从c点到d点,溶液中  的值保持不变 的值保持不变C.溶液中水的电离程度:b>c D.a点时,相同体积的两溶液分别与NaOH恰好中和后,溶液中的n(Na+)相等 |
|
| 13. 选择题 | 详细信息 |
用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是 A.燃料电池工作时,负极反应为HCHO+H2O-4e-=CO2+4H+ B.当燃料电池消耗2.24L甲醛气体时,电路中理论上转移0.2mole- C.当a、b都是铜电极时,电解的总反应方程式为:2CuSO4+2H2O D.电解后,消耗的甲醛和a电极上析出物质的物质的量相等 |
|
| 14. 选择题 | 详细信息 |
某充电宝锂离子电池的总反应为 A.锂离子电池放电时,Li+移向正极 B.如图表示用锂离子电池给镍氢电池充电 C.锂离子电池充电时,阴极的电极反应式: D.镍氢电池放电时,正极的电极反应式: |
|
| 15. 选择题 | 详细信息 |
25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[一lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下,Ksp[Cu(OH)2]2],下列说法正确的是 ( ) A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1 B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):C(Cu2+):1:104.6 C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量Cu0 |
|
| 16. 选择题 | 详细信息 |
将NaHCO3和Na2O2的固体混合物x g在密闭容器中加热至250℃,充分反应后排出气体.将反应后的固体溶入水无气体放出,再逐滴加入盐酸,产生气体(标准状况)与所加盐酸体积之间的关系如图所示.下列说法错误的是( ) A.HCl的浓度0.2mol/L B.反应后固体的成分为NaOH与Na2CO3 C.密闭容器中排出气体的成分为O2和H2O D.x的数值为6.09 |
|
| 17. 实验题 | 详细信息 | ||||||||||||
|
亚硝酸钠(NaNO2)是一种重要的工业用盐,某同学针对亚硝酸钠设计了如下实验: 已知:①2NO+Na2O2=2NaNO2 ②2NO2+Na2O2=2NaNO3 ③3NaNO2+3HC1=3NaC1+HNO3+2NO↑+H2O ④酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。  (1)该同学用以上仪器制备NaNO2,则装置的连接顺序为A→___→____→____→___→E。(填序号,可重复)。_______________ (2)仪器a的名称为_____________。 (3)D装置的作用___________________、_________________(用化学方程式表示)。 (4)E装置的作用_______________________________________。 (5)比色法测定样品中的NaNO2含量: ①在5个有编号的带刻度试管中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2的浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
|
|||||||||||||
| 18. | 详细信息 | ||||||
|
某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。 已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;常温下H2C2O4为晶体,易溶于水,溶解度随温度升高而增大。  请回答: (1)步骤②,发生反应的离子方程式____________________________;该步骤H2C2O4稍过量主要是为了_________________。 (2)下列操作或描述正确的是_______________。 A.步骤①,酸化主要是为了抑制Fe2+水解 B.步骤③,如果采用冷水洗涤可提高除杂效果 C.步骤③,如果在常压下快速干燥,温度可选择略高于100℃ (3)称取一定量的FeC2O4·2H2O试样,用硫酸溶解,采用KMnO4滴定法测定,折算结果如下:
|
|||||||
| 19. 综合题 | 详细信息 |
|
一氧化二氮(Nitrous oxide),无色有甜味气体,又称笑气,“笑气”的名称是由于吸入它会感到欣快,并能致人发笑。1799年,英国化学家汉弗莱·戴维发现了该气体。一氧化二氮早期被用于牙科手术的麻醉,现用在外科手术和牙科起麻醉和镇痛作用。 (1)N2O在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g) △H。 已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) △H1 4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H2 △H=________(用含△H1、△H2的代数式表示)。 (2)N2O和CO是环境污染性气体,这两种气体会发生反应:N2O(g)+CO(g) (3)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应:2N2O(g) 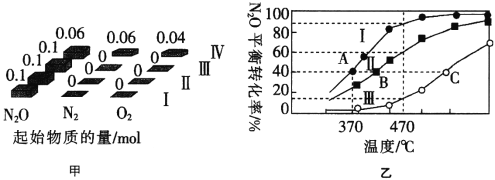 ①该反应的△H______(填“>”或“<”)0。 ②容器II的体积为0.5L,在470℃下进行反应,30s后达到平衡,0~30s内容器II中O2的反应速率为_______mol·L-1·s-1。 ③已知容器I的体积为1L,370℃时,该反应的平衡常数k=________(保留两位有效数字)。 ④图中A、B、C三点处容器内密度最大的点是________(填“A”“B”或“C”)。 |
|
| 20. | 详细信息 |
镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如下图是从该矿渣中回收NiSO4的工艺路线: 已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第IVA族。 (1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是_______________。 (2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为_________________________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有___________________(填化学式)。 (3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将:Fe3+还原为Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的_____倍:除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为_________________________________________。 (4)“浸出液”中c(Ca2+)=1.0×10-3mol·L -1,当除钙率达到99%时,溶液中c(F-)=___mol· L-1。[已知KSP(CaF2)=4.0×10-11] (5)已知正十二烷可用作该工艺的萃取剂。用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。已知电解总反应为:2C6H13COONa+2CH3OH |
|
最近更新



