四川省广元中学2021届高三10月月考化学在线考试题带答案和解析
| 1. 选择题 | 详细信息 |
|
2020年“新冠”疫情在全球肆虐。下列说法不正确的是( ) A.酒精可以杀灭病毒是因为其能使构成病毒的蛋白质变性 B.研究表明,病毒可以通过气溶胶传播,气溶胶粒子的直径在 C.口罩的核心材料熔喷布聚丙烯是一种有机高分子化合物 D.“84”消毒液的主要成分是HClO |
|
| 2. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法正确的是 A.0.1molFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA B.0.1mol过氧化钙(CaO2)固体中阴、阳离子总数为0.3NA C.2.4gMg与H2SO4完全反应,转移的电子数为0.2NA D.标准状况下,2.24LCCl4含有的共价键数为0.4NA |
|
| 3. 选择题 | 详细信息 |
化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( ) A.分子中两个苯环一定处于同一平面 B.不能与饱和 C.在酸性条件下水解,水解产物只有一种 D.1mol化合物X最多能与 |
|
| 4. 选择题 | 详细信息 |
|
下列反应的离子方程式表达正确的是( ) A.FeCl3溶液中滴加HI溶液:2Fe3++2HI=2Fe2++2H++I2 B.Na2CO3溶液处理水垢中的硫酸钙:CaSO4(s)+ C.NH4HSO4溶液中滴加少量Ba(OH)2溶液: D.酸化NaIO3和NaI的溶液:I-+ |
|
| 5. 选择题 | 详细信息 | |||||||||||||||
由下列实验及现象推出的相应结论不正确的是
A.A B.B C.C D.D |
||||||||||||||||
| 6. 选择题 | 详细信息 |
|
短周期主族元素X、Y、Z、W原子序数依次增加,X原子的半径小于Y原子,Y是地壳中含量最高的元素,Z原子的最外层只有1个电子,Y、W同主族。下列说法正确的是( ) A.原子半径: C.W元素形成的最高价氧化物的水化物是强酸 D.X与Z形成的化合物中X为 |
|
| 7. 选择题 | 详细信息 |
如图是一种新型燃料电池,O2-可在高温条件下在固体氧化物电解质中自由移动,电极上产生的均为无毒无害的物质。下列说法正确的是 A.电极甲为正极,发生氧化反应 B.电池内的O2-由电极甲移向电极乙 C.电池总反应为N2H4 +O 2=N2 +2H2O D.当甲电极上有32g N2H4消耗时,乙电极上有22.4L O2参与反应 |
|
| 8. 实验题 | 详细信息 |
亚硝酸钠(NaNO2)是一种肉制品生产中常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组设计了如下图所示的装置制备NaNO2(A中加热装置已略去,NO可与过氧化钠粉末发生化合反应,也能被酸性KMnO4氧化成 (1)仪器a的名称是_________。 (2)A中实验现象为____________________________________。 (3)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是_________(填字母序号)。 A.烧碱 B.无水CaCl2 C.碱石灰 D.浓硫酸 (4)E中发生反应的离子方程式为____________________________________。 (5)从提高氮原子利用率的角度出发,其中B装置设计存在一定缺陷,如何改进?_______。 (6)已知:2NO 滴定终点时的实验现象为_________,该样品中NaNO2纯度为_________。 |
|
| 9. | 详细信息 | |||||||||||||||
某矿渣的主要成分为Cu2O,其次含少量Al2O3、Fe2O3、SiO2等,工业上用该矿渣获取铜和胆矾的操作流程如图: 已知:①Cu2O+2H+=Cu+Cu2++H2O ②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
(1)为了加快反应Ⅰ的速率,可以采取的措施是_____(任写1条) |
||||||||||||||||
| 10. | 详细信息 |
|
硫单质及其化合物在工农业生产中有着重要的应用。请回答下列问题: (1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下: ①CaSO4(s)+CO(g) ② 反应CaO(s)+3CO(g)+SO2(g) (2)图1为在密闭容器中H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。  图1中压强p1、p2、p3的由大到小的顺序为__________。理由是_________________。计算温度T1、压强p1下(N点)平衡常数Kp=__________。(Kp为以分压表示的平衡常数,分压=总压×物质的量分数) (3)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段是__________。 ②据图2判断,反应进行至20 min时,曲线发生变化的原因是__________(用文字表达)。10min到15 min的曲线变化的原因可能是__________(填写字母)。 A.加了催化剂 B.降低温度 C.缩小容器体积 D.增加SO2的物质的量 |
|
| 11. | 详细信息 |
|
以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]。 (1)Fe基态核外电子排布式为__________;[Fe(H2O)6]2+中与Fe2+配位的原子是_________(填元素符号)。 (2)NH3分子中氮原子的轨道杂化类型是__________;C、N、O元素的第一电离能由大到小的顺序为__________。 (3)与 (4)柠檬酸的结构简式见图(  )。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为__________NA。 )。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为__________NA。(5)经X射线衍射测定发现,晶体铁在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于__________。若该堆积方式下的晶胞参数为a cm,则铁原子的半径为_________pm。 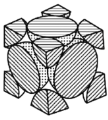 |
|
| 12. | 详细信息 |
华法林(物质F)是一种香豆素类抗凝剂,在体内有对抗维生素K的作用,可用于预防栓塞性疾病。某种合成华法林的路线如下图所示。请回答下列相关问题。 (1)华法林的分子式是___________。物质E中的含氧官能团名称是___________。 (2)A→B的氧化剂可以是__________(填标号)。 a.银氨溶液 b.氧气 c.新制Cu(OH)2悬浊液 d.酸性KMnO4溶液 (3)C→D的化学方程式是______________________________________________。 (4)E→F的反应类型是______________________。 (5)物质C的同分异构体中符合下列条件的有____种(不考虑立体异构)。并写出其中一种的结构简式__________。 ①含有苯环;②苯环上有两个取代基;③含有-COO-结构且不含甲基 (6)以  和(CH3CO)2O为原料制备 和(CH3CO)2O为原料制备 |
|
最近更新



