湖南省长沙市周南中学2020-2021年高二上学期第三次月考化学题带答案和解析
| 1. 选择题 | 详细信息 |
|
下列热化学方程式中ΔH数值代表燃烧热的是( ) A.CH4(g)+2O2(g)=2H2O(1)+CO2(g) ΔH1 B.S(s)+ C.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(g) ΔH3 D.2CO(g)+O2(g)=2CO2(g) ΔH4 |
|
| 2. 选择题 | 详细信息 |
|
在一定条件下,反应N2+3H2⇌2NH3在10L恒容密闭容器中进行,测得2min内,H2的物质的量由20mol减少到8mol,则2min内NH3的化学反应速率为( ) A.1.2mol⋅(L⋅min)−1 B.6mol⋅(L⋅min)−1 C.0.4mol⋅(L⋅min)−1 D.0.6mol⋅(L⋅min)−1 |
|
| 3. 选择题 | 详细信息 |
|
英国俄勒冈大学的化学家使用了一种名为 trans-Fe(DMeOPrPE)2的新催化剂在常温下合成氨,反应方程式可表示为N2+3H2 A.新法合成氨不需要在高温条件下进行,可节约大量能源 B.新法合成氨能在常温下进行是因为不需要断裂化学键 C.传统合成氨方法的ΔH>0,新型合成氨方法的ΔH<0 D.新催化剂提高了活化分子百分数,加快了化学反应速率,使平衡正向移动 |
|
| 4. 选择题 | 详细信息 |
—定条件下,合成乙烯的反应为6H2(g)+2CO2(g)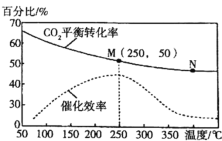 A.该反应的逆反应为放热反应 B.生成乙烯的速率: C.增大压强,平衡正向移动,平衡常数K的值将增大 D.当温度高于250℃,升高温度,催化剂的催化效率会降低 |
|
| 5. 选择题 | 详细信息 |
|
在相同温度时,100mL0.01mol•L﹣1的醋酸溶液与10mL 0.1mol•L﹣1的醋酸溶液相比较,下列数值中,前者大于后者的是( ) A.H+的物质的量 B.醋酸的电离常数 C.中和时所需NaOH的量 D.CH3COOH的物质的量 |
|
| 6. 选择题 | 详细信息 |
|
常温下,将足量的AgCl固体分别放入下列液体中,AgCl溶解的量最小的是( ) A.20 ml蒸馏水 B.30mL 0.03mol/L HCl溶液 C.40mL 0.05mol/L AgNO3溶液 D.50mL 0.02mol/L CaCl2溶液 |
|
| 7. 选择题 | 详细信息 |
|
下列方程式书写正确的是( ) A.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++HSO B.H2SO3的电离方程式:H2SO3 C.CO D.CaCO3沉淀溶解平衡方程式:CaCO3(s)= Ca2+(aq)+CO |
|
| 8. 选择题 | 详细信息 |
|
下列说法正确的是 A.放热或熵减小均有利于反应的正向自发进行 B.ΔH>0,ΔS<0的反应在任何温度下均能正向自发进行 C.2H2O2(aq)==2H2O(l)+O2(g) ΔH=-189.3 kJ· mol−1,任何温度下均可正向自发进行 D.向水中加入NH4NO3固体,溶液温度降低,可说明铵盐水解是吸热的 |
|
| 9. 选择题 | 详细信息 |
|
某温度下,纯净水中的c(H+)=1×10−6 mol∙L−1,则该温度下0.01 mol∙L−1的NaOH溶液的pH为( ) A.2 B.6 C.10 D.12 |
|
| 10. 选择题 | 详细信息 |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是( ) A.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO B. C.0.1 mol·L−1 KI 溶液中:Na+、K+、ClO−、OH− D.能使酚酞变红的溶液中:Na+、NH |
|
| 11. 选择题 | 详细信息 |
|
下列关于盐类水解应用的说法不正确的是 A.配制一定浓度的 FeSO4 溶液时,将 FeSO4 固体溶于硫酸中,然后稀释至所需浓度 B.将 Fe2(SO4)3的溶液蒸干,灼烧可得到 Fe2(SO4)3固体 C.明矾可以用来净水,是利用明矾水解生成 Al(OH)3 胶体,从而起到杀菌消毒功效 D.草木灰(有效成分 K2CO3)不能与NH4Cl混合使用,是因为 K2CO3 与 NH4Cl 发生水解生成氨气会降低肥效 |
|
| 12. 选择题 | 详细信息 |
|
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是( ) A.pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低 B.等浓度的三种盐溶液NaX、NaY和NaZ的pH依次为8、9、10,则HX、HY、HZ的酸性:HX>HY>HZ C.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO D.pH=2盐酸和pH=12的氨水等体积混合:c(H+)>c(OH-) |
|
| 13. 选择题 | 详细信息 |
有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的 KCl 饱和溶液)  A.正极反应为 Zn- 2e- == Zn2+ B.取出盐桥后,检流计依然发生偏转 C.反应中,盐桥中的 K+会移向 CuSO4 溶液 D.电子从负极流向正极,再经盐桥流回负极 |
|
| 14. 选择题 | 详细信息 |
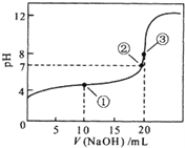
25℃时,向10mL 0.10mol/L的一元弱酸HA(Ka=1.8×10-3)中逐滴加入0.10 mol/L NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( ) A.溶液在a点和b点时水的电离程度相同 B.a点时,c(HA)+c(OH-)=c(Na+)+c(H+) C.V=10 mL时,c(Na+)>c(A-)>c(H+)>c(HA) D.b点时,c(Na+)=c(HA)+c(A-)+c(OH-) |
|
| 15. 选择题 | 详细信息 |
以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数 下列叙述正确的是 A. 曲线①代表 B. H2A溶液的浓度为0.2000 mol·L−1 C. HA−的电离常数Ka=1.0×10−2 D. 滴定终点时,溶液中 |
|
| 16. 填空题 | 详细信息 |
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C的变化如图所示。 (1)写出反应的化学方程式______。 (2)0~4min时,A的平均反应速率为______。 (3)已知:K(300℃)>K(350℃),该反应是______(填“吸热”或“放热”)反应。 (4)T℃时,反应的平衡常数为______(保留到小数点后2位)。 (5)到达平衡时B的转化率为______。 (6)如图是上述反应平衡混合气中C的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是______(填“温度”或“压强”)。判断L1_____L2(填“>”或“<”),理由是_____。 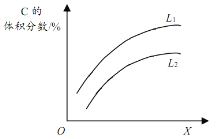 |
|
| 17. | 详细信息 | ||||||||||||
Ⅰ.结合表回答下列问题(均为常温下的数据):
请回答下列问题: |
|||||||||||||
| 18. | 详细信息 | ||||||||||
软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如图: 已知:①部分金属阳离子完全沉淀时的pH如表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。 |
|||||||||||
| 19. 实验题 | 详细信息 | ||||||||||||||||||||||||||||||||||||||
|
高锰酸钾是化学实验中的常用试剂。 Ⅰ.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,回答下面问题: (1)发生反应的离子方程式为:___________。 (2)已知随着反应进行试管的温度升高,化学反应速率与时间的关系如图:  时间t1以前反应速率缓慢增大的原因是___________。 (3)某同学探究“外界条件改变对化学反应速率的影响”进行了如表实验:
通过A与B,A与C进行对比实验,填写下列数值,T1=___________ K;V3=___________ mL。 |
|||||||||||||||||||||||||||||||||||||||
 C.
C.