江苏九年级化学期中考试(2019年下半年)试卷带答案和解析
| 1. 选择题 | 详细信息 |
“关爱生命,注意安全,拥抱健康”是永恒的主题。下列做法正确的是( ) A. A B. B C. C D. D |
|
| 2. 选择题 | 详细信息 |
|
下列变化中,只发生了物理变化的是( ) A. 植物光合作用 B. 苹果腐烂变质 C. 矿石研磨成粉 D. 酸雨腐蚀建筑 |
|
| 3. 选择题 | 详细信息 |
|
下列实验操作中,不正确的是( ) A.  加热液体 B. 加热液体 B.  蒸发食盐水 蒸发食盐水C.  稀释浓硫酸 D. 稀释浓硫酸 D.  二氧化碳验满 二氧化碳验满 |
|
| 4. 选择题 | 详细信息 | |||||||||||||||||||||||||
下列分类正确的是( )
|
||||||||||||||||||||||||||
| 5. 选择题 | 详细信息 |
|
下列与水有关的说法不正确的是( ) A. 在固态时水分子是静止不动的 B. 中和反应有水生成 C. 水分子保持水的化学性质 D. 电解水是验证水的组成的方法之一 |
|
| 6. 选择题 | 详细信息 |
|
下列有关实验现象的描述错误的是( ) A. 红磷在空气中燃烧,产生大量白烟,放热 B. 铁丝在氧气中燃烧,火星四射,生成黑色固体,放热 C. 木炭在氧气中燃烧,发出明亮的白光,生成二氧化碳 D. 硫在空气中燃烧,产生淡蓝色火焰,生成有刺激性气味的气体,放热 |
|
| 7. 选择题 | 详细信息 |
|
下列有关山梨酸钾(C6H7KO2)的说法不正确的是( ) A. 山梨酸钾中氢元素的质量分数最小 B. 一个山梨酸钾分子中含有16个原子 C. 山梨酸钾是由碳、氢、钾、氧四种元素组成的化合物 D. 山梨酸钾中碳、氢、钾、氧四种元素的质量比为6:7:1:2 |
|
| 8. 选择题 | 详细信息 | |||||||||||||||
下列实验操作能达到实验目的的是( )
|
||||||||||||||||
| 9. 选择题 | 详细信息 |
如图是镉元素在元素周期表中的信息和镉原子结构示意图。下列说法错误的是( ) A. 镉的原子序数和原子核内中子数均为48 B. 镉是一种对人体有害的金属元素 C. 镉的相对原子质量为112.4 D. 化学反应中,镉原子易失电子 |
|
| 10. 选择题 | 详细信息 | ||||||||||||||||||||
下列实验现象和实验结论均正确的是( )
|
|||||||||||||||||||||
| 11. 选择题 | 详细信息 |
甲、乙、丙三种物质的溶解度曲线如图所示。下列说法错误的是( ) A. 欲将丙物质的不饱和溶液变为饱和溶液,可采取升高温度的方法 B. t2℃时,30g甲物质加入50g水中,充分搅拌后,所得溶液的溶质的质量分数为37.5% C. 将相同质量的甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,析出晶体最多的是甲 D. t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙 |
|
| 12. 选择题 | 详细信息 | ||||||||
下列知识整理的内容不完全正确的一组是( )
|
|||||||||
| 13. 选择题 | 详细信息 | |||||||||||||||
在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示。下列说法正确的是( )
|
||||||||||||||||
| 14. 选择题 | 详细信息 |
|
如图中的图象与对应变化关系不相符的是( ) A. 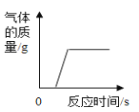 向部分变质的氢氧化钠溶液中滴加盐酸 向部分变质的氢氧化钠溶液中滴加盐酸B.  向Cu(NO3)2和AgNO3混合溶液中逐渐加入锌 向Cu(NO3)2和AgNO3混合溶液中逐渐加入锌C.  向氢氧化钡溶液中逐滴加入稀硫酸 向氢氧化钡溶液中逐滴加入稀硫酸D.  向等质量、等溶质质量分数的稀盐酸中分别加入足量的镁片和锌片 向等质量、等溶质质量分数的稀盐酸中分别加入足量的镁片和锌片 |
|
| 15. 选择题 | 详细信息 |
|
现有一包由5.6g铁、7.2g镁、1.4g碳混合而成的粉末,把它加入一定量的Cu(NO3)2溶液中。实验结束后,测得剩余固体中含有三种物质。则剩余固体的质量可能会( ) A. 25.8g B. 26.8g C. 27.8g D. 28.8g |
|
| 16. 填空题 | 详细信息 |
|
化学与生产生活密切相关。 (1)请从下列物质中选择相应的序号填空: A氩气 B硝酸钾 C氧化钙 ①常用作食品干燥剂的是_____; ②可用于填充霓虹灯的是_____; ③农业上用作复合肥的是_____。 (2)生活中常用于区分硬水和软水的是_____: (3)包饺子的食材有面粉、韭菜、瘦肉、植物油、食盐等,其中富含糖类的是_____,属于有机物的是_____。 |
|
| 17. 实验探究题 | 详细信息 |
根据下列实验装置图回答问题: (1)写出图中仪器a的名称:_____; (2)实验室用双氧水制取氧气应选用的发生装置为_____(填字母序号),若要收集比较纯净的氧气应选择的收集装置为_____(填字母序号),写出该反应的化学方程式_____。 (3)组装发生装置A时,下列仪器、用品的组装顺序是_____(填字母序号)。 a试管 b酒精灯 c铁架台 d木块 (4)实验室用石灰石和盐酸反应制取二氧化碳,某同学将制得的二氧化碳气体通入澄清石灰水中,未观察到明显现象,其可能的原因是_____。 (5)F装置可用来测量生成CO2的体积,在水面上放一层植物油的目的是_____,植物油上方原有的空气对实验结果_____(填“有”或“没有”)明显影响。 |
|
| 18. 简答题 | 详细信息 |
|
盐城起亚汽车制造需要铝等金属。 (1)铝具有很好的抗腐蚀性能是因为_____。 (2)在2A1+2X+2H2O=2NaA1O2+3H2↑反应中,X的化学式为_____,生成物NaA1O2中铝元素的化合价为_____。 (3)利用下列各组试剂,不能判断出铝、铁、铜三种金属的活动性顺序的是_____。 A A1、Cu、FeSO4溶液 B Fe、AlC13溶液、CuCl2溶液 C A1、Fe、Cu、HCl溶液 D Cu、A1(NO3) 3溶液、Fe(NO3) 3溶液 |
|
| 19. 流程题 | 详细信息 | ||||||||||
|
盐城濒临黄海,海水中含有NaCl、CaCl2等 (1)下列方法中能淡化海水的是_____(填字母)。 A分解法 B吸附法 C蒸馏法 (2)从海水中获取粗盐,宜选用_____(填“蒸发结晶”或“降温结晶”)。为了除去粗盐溶液中的Ca2+、Mg2+、SO42﹣,可按照下列实验步骤进行:①加过量BaC12溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④操作X;⑤加入适量盐酸。其中步骤③加过量Na2CO3溶液的目的是_____:步骤④操作X的名称是_____。 (3)海水提镁流程: 写出b步骤发生反应的化学方程式_____,提取氯化镁历经a、b两步转换的目的是_____。经过a步骤生成的氢氧化镁需要洗涤,检验氢氧化镁是否洗净的方法是:取少量最后一次洗涤液于试管中,滴加少量稀硝酸和_____溶液,若无白色沉淀生成,说明已洗净。 (4)如为氯化钠在不同温度时的溶解度。结合表中数据回答:
|
|||||||||||
| 20. 科学探究题 | 详细信息 |
|
某兴趣小组对木炭还原氧化铜生成的气体成分进行实验探究。 (提出问题)碳与氧化铜反应可能生成什么气体? (猜想与假设) 猜想①:只生成CO2:猜想②:_____;猜想③:既生成CO又生成CO2 (查阅资料) ①浸有磷钼酸溶液的氯化钯试纸遇CO2无变化,但遇微量CO也会立即变蓝; ②氮的氧化物有毒。 (实验验证)  小组同学设计了如图所示的实验装置: 步骤一:打开弹簧夹,先通一会儿纯净干燥的氮气; 步骤二:关闭弹簧夹,点燃酒精灯对玻璃管加热; 步骤三:实验结束后,拆洗装置和仪器。 (1)实验开始时,先将氮气通入实验装置一段时间再加热的目的是_____; (2)对A装置的玻璃管集中加热一段时间,玻璃管中黑色粉末逐渐变成红色,B瓶中试纸变蓝,C中澄清石灰水变浑浊。写出C中发生反应的化学方程式_____。 (实验结论) (3)通过对实验现象的分析,上述猜想_____(填序号)是正确的。 (反思与交流) 实验结束后,同学发现玻璃管内壁附着的铜用水不易清洗干净,通过查阅资料获得三种能清除铜的方案: Ⅰ.加入浓硫酸并微热:Cu+2H2SO4 (浓) Ⅱ.加入浓硝酸与铜反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2+2H2O Ⅲ.加入氯化铁溶液:Cu+2FeCl3=2FeCl2+CuC12 (4)上述清除铜的最佳方案是_____(填序号),理由是_____。 (拓展提升)有一袋已部分变质的Ca(OH)2(含杂质CaCO3)固体样品,把该样品投入足量水中,充分搅拌后通入二氧化碳,沉淀质量与反应的二氧化碳质量关系如图所示。  (提示:CO2+CaCO3+H2O=Ca(HCO3)2) 计算样品中碳酸钙的质量分数。______(写出计算过程,结果精确到0.1%) |
|




