高三化学专题练习(2019年下半年)附答案与解析
| 1. 选择题 | 详细信息 |
|
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定NaClO与NaClO3的物质的量之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为 A.3:11 B.11:3 C.1:4 D.4:1 |
|
| 2. 选择题 | 详细信息 |
|
四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具 A.参加反应的氧化剂与还原剂的物质的量之比为1:5 B.若有2molFe2+ 被氧化,则被Fe2+还原的O2的物质的量为0.5 mol C.每生成1 molFe3O4 ,反应转移的电子为4 mol D.O2是氧化剂,S2O32-与Fe2+是还原剂 |
|
| 3. 选择题 | 详细信息 |
|
将1.52 g铜镁合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1120 mL(标准状况),向反应后的溶液中加入1.0 mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是 A.该合金中铜与镁的物质的量之比是1∶2 B.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1 C.NO2和N2O4的混合气体中,NO2的体积分数是80% D.得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL |
|
| 4. 选择题 | 详细信息 |
|
NA表示阿伏加德罗常数的值。下列叙述错误的是( ) A. 18g果糖分子中官能团数目为0.6NA B. 已知:3BrF3+5H2O=HBrO3+Br2+9HF+O2↑,如果有15molH2O参加反应,则由水还原的BrF3分子数目为4NA C. 常温下,5.6gFe与含0.2molHNO3的溶液充分作用,最少会失去电子数为0.15NA D. 标准状况下,11.2LCH3Cl所含的极性键数目等于2NA |
|
| 5. 选择题 | 详细信息 |
|
现有2.8 g Fe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是 A. 反应后溶液中铁元素可能以Fe2+形式存在 B. 反应后的溶液最多还能溶解1.4 g Fe C. 反应后溶液中c(NO3−)=0.85 mol·L−1 D. 1.12 L气体可能是NO、NO2的混合气体 |
|
| 6. 选择题 | 详细信息 |
|
将物质的量均为a mol的FeCl3和CuCl2投人水中形成混合溶液,再加入bmol铁粉充分反应(忽略离子的水解),下列说法中不正确的是( ) A. 当a/2<b<3a/2时,反应后的溶液中n(Cu2+):n(Fe2+)= (3a/2-b):(b+a) B. 当b≥3a/2时,发生总反应的离子方程式为2Fe3++Cu2++2Fe=4Fe2++Cu C. 当b≤a/2时,发生的离子反应为2Fe3++Fe=3Fe2+ D. 当a/2<b<3a/2时,反应中转移电子的物质的量:a mol<n(e-)<3a mol |
|
| 7. 选择题 | 详细信息 |
|
将12.8g铜片加入到100mL一定浓度的硝酸溶液中,铜片完全溶解,产生NO和NO2的混合气体4.48L(标准状况下);若向反应后的溶液中加入400mL 2mol/LNaOH溶液,能使溶液中的Cu2+恰好完全沉淀.下列说法不正确的是 A.铜片与硝酸反应过程中转移电子0.4mol B.反应后溶液中剩余 C.混合气体中NO和 D.原硝酸溶液的物质的量浓度为10mol/L |
|
| 8. 选择题 | 详细信息 |
|
向含a mol NaClO的溶液通入b mol SO2充分反应(不考虑二氧化硫与水之间的反应以及次氯酸的分解)。下列说法不正确的是 A.当0<b<a/3时:SO2+H2O+3ClO-= B.当b=a时,SO2+H2O+ClO-==2H++Cl-+ C.当a/3≤b≤a时,反应后溶液中H+的物质的量: 0<n(H+)≤2b mol D.当0<b<a时,反应后溶液中ClO-、Cl-和 |
|
| 9. 选择题 | 详细信息 |
向含Fe2+、I-、Br-的混合溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( ) A.线段Ⅱ表示Br-的变化情况 B.原溶液中n(FeI2):n(FeBr2)=3:1 C.根据图像无法计算a的值 D.线段Ⅳ表示HIO3的变化情况 |
|
| 10. 选择题 | 详细信息 |
|
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol, 这些气体恰好能被 600mL 2mol•L-1 NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为 A.0.2mol B.0.4mol C.0.6mol D.0.8mol |
|
| 11. 选择题 | 详细信息 |
将 38.4g 铜与适量浓硝酸恰好反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如下图所示: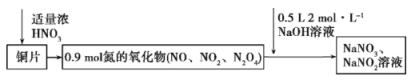 下列有关判断正确的是( ) A. 若浓硝酸体积为 200mL,则其物质的量浓度为 11mol/L B. NO、NO2、N2O4 和 NaOH 溶液反应时, NO2、N2O4 仅作还原剂 C. 生成 0.2 mol NaNO3 和 0.8 mol NaNO2 D. 硝酸在反应中仅体现氧化性 |
|
| 12. 选择题 | 详细信息 |
|
羟氨(NH2OH)是一种还原剂.将25.00mL 0.049mol/L的羟氨酸性溶液与足量硫酸铁在煮沸条件下反应,生成的Fe2+又恰好被24.50mL 0.020mol/L的酸性KMnO4溶液所氧化.在上述反应中,羟氨的氧化产物为 A. NO2 B. NO C. N2O D. N2 |
|
| 13. 选择题 | 详细信息 | ||||||
己知HNO2在低温下较稳定,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表,且酸性:
|
|||||||
| 14. 选择题 | 详细信息 |
高纯碳酸锰在电子工业中有着重要的应用,湿法浸出软锰矿(主要成分为MnO2,含有少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的流程如下:其中除杂过程包括:①向浸出液中加入一定量的试剂X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是(已知室温下:Kap[Mg(OH)2]=1.8×10-11,Kap[Al(OH)3]=3.0×10-34,Kap[Fe(OH)3]=4.0×10-38。)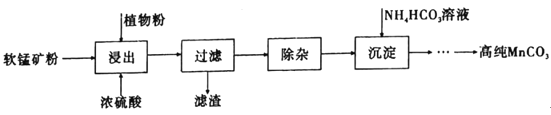 A.浸出时加入植物粉的作用是作为还原剂 B.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质 C.试剂X可以是MnO、MnO2、MnCO3等物质 D.为提高沉淀MnCO3步骤的速率可以持续升高温度 |
|
| 15. 选择题 | 详细信息 |
|
一定量的铁与一定量的浓HNO3在加热条件下恰好完全反应,得到硝酸铁溶液和NO2 、N2O4 、NO的混合气体,这些气体与6.72 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铁溶液中加入2 mol·L-1 的NaOH 溶液至Fe3+恰好沉淀,则消耗NaOH 溶液的体积是( ) A. 600 mL B. 300 mL C. 240 mL D. 180 mL |
|
| 16. 选择题 | 详细信息 |
|
磁黄铁矿 A.mg该磁黄铁矿中含+2价的铁0.75mol B.200mL盐酸中HCl物质的量浓度为4.25mol•L-1 C.生成的H2S气体在标准状况的体积为16.8L D.该磁黄铁矿中Fe1-nS的n=0.15 |
|
| 17. 选择题 | 详细信息 |
|
从矿物学资料查得,在一定条件下自然界存在如下反应: A.X的化学式为Cu2S,它既是氧化产物又是还原产物 B.5molFeS2发生反应,有10mol电子转移 C.每当有12molH2O参加反应时,被CuSO4氧化的FeS2的物质的量为1mo1 D.上述反应中做氧化剂的FeS2和做还原剂的FeS2的物质的量之比为3:7 |
|
| 18. 选择题 | 详细信息 |
|
将15.2 g 铜和镁组成的混合物加入250 mL4.0 mol • L-1的稀硝酸中,固体完全溶解,生成的气体只有NO。向所得溶液中加入1.0 L NaOH溶液,此时金属离子恰好沉淀完全,沉淀质量为25.4 g,下列说法不正确的是 A. 原固体混合物中,Cu和Mg的物质的量之比为2:1 B. 氢氧化钠溶液的浓度为0.8 mol·L-1 C. 固体溶解后的溶液中硝酸的物质的量为0.1mol D. 生成的NO气体在标况下的体积为4.48L |
|
| 19. 选择题 | 详细信息 |
|
铅的冶炼过程大致如下: A.浮选法富集方铅矿的过程发生化学变化 B.将 C.整个冶炼过程中,制取 D.方铅矿焙烧的反应中,PbS是还原剂,还原产物只有PbO |
|
| 20. 选择题 | 详细信息 |
对SCN-的性质进行探究,设计了以下实验 已知:(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质均与卤素单质相似。下列说法正确的是( ) A.溶液颜色变红时发生反应的离子方程式是:Fe3++3SCN-=Fe(SCN)3↓ B.红色溶液褪色表现了SO2的漂白性 C.氧化性:KMnO4>Fe3+>(SCN)2 D.无色溶液Ⅱ中滴入适量的KMnO4(H+)溶液,溶液又变成红色 |
|
| 21. 选择题 | 详细信息 |
|
多硫化钠Na2Sx( A.5 B.4 C.3 D.2 |
|
| 22. 选择题 | 详细信息 |
|
将a g铁和氧化铁的混合物加入800 mL pH=1的盐酸中充分反应后,固体无剩余,盐酸全部消耗,放出气体0.224 L(标准状况下)。则下列判断中正确的是( ) A. 原混合物中n(Fe)∶n(Fe2O3)=2∶1 B. 向溶液中滴入无色的KSCN溶液,显红色 C. 无法计算出原混合物的质量 D. 此时溶液中Fe2+和Fe3+的物质的量之比为3∶1 |
|
| 23. 选择题 | 详细信息 |
|
向葡萄酒中加入Na2S2O5抗氧化。测定某葡萄酒中Na2S2O5残留量的方法:取50.00ml葡萄酒样品,用0.0100mol•L-1的碘标准液滴定至终点,消耗标准液10.00ml。则该样品中Na2S2O5的残留量为 A.0.001g•L-1 B.0.002g•L-1 C.0.064g•L-1 D.0.19g•L-1 |
|
| 24. 选择题 | 详细信息 |
|
11.9g金属锡(Sn)跟100mL12mol·L-1 HNO3共热一段时间。完全反应后测定溶液中c(H+)为8 mol·L-1,溶液体积仍为100mL。产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol。由此推断氧化产物可能是( ) A.SnO2·4H2O B.Sn(NO3)4 C.Sn(NO3)2 D.Sn(NO3)2和Sn(NO3)4 |
|
| 25. 计算题 | 详细信息 |
|
在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。 (1)写出该实验中发生反应的化学方程式:_____________ _____________ _____________ (2)试通过计算确定该钠块中钠元素的质量分数为_________ |
|
| 26. 计算题 | 详细信息 |
|
单质硫在NaOH的热浓溶液中发生歧化反应,将2.56g硫与含0.0600molNaOH的热溶液反应恰好生成amolNa2Sx和bmolNa2S2O3,再加入1.00mol/L的NaClO溶液VmL,使溶液中所有硫元素全部转化为Na2SO4。计算:(1)a/b=________; (2)V至少为___________。 |
|
| 27. 解答题 | 详细信息 |
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节.某研究性学习小组设计了将粗MnO2含有较多的MnO和MnCO3样品转化为纯MnO2实验,其流程如图: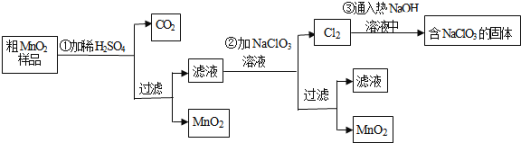 ______ ______+_____ClO3-+ _____Mn2+=______MnO2+______Cl2↑+______ ______ |
|
| 28. 计算题 | 详细信息 |
|
已知还原性: |
|
| 29. | 详细信息 | |||||||||||||||
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下。 其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。 (1)酸浸时,为了提高浸取率可采取的措施有______________ (2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_____________。 (3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
|
||||||||||||||||
| 30. 综合题 | 详细信息 | ||||||||
市场销售的某种食用精制盐包装袋上有如下说明:
|
|||||||||
| 31. 推断题 | 详细信息 | ||||||||
短周期元素X、Y、Z、W在周期表中的位置关系如图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
|
|||||||||
| 32. | 详细信息 |
碱性锌锰电池的工作原理:Zn+2MnO2+2H2O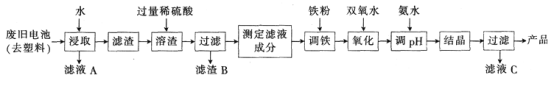 (1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为___________。 (2)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:_________________________________。 (3)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。 ①写出“调铁”工序中发生反应的离子方程式:______________________、_______。 ②若测得滤液的成分为c(Mn2+)+c(Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1 m3,“调铁”工序中,需加入的铁粉质量为___________kg(忽略溶液体积变化,用含a、b的代数式表示)。 (4)在“氧化”工序中,加入双氧水的目的是把 Fe 2+ 氧化为 Fe 3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是______________________。 (5)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为_______________。 |
|




